Suchergebnis
vom: 17.11.2015
Bundesministerium für Umwelt, Naturschutz, Bau und Reaktorsicherheit
BAnz AT 03.05.2016 B4
Bundesministerium
für Umwelt, Naturschutz, Bau und Reaktorsicherheit
Bekanntmachung
einer Empfehlung mit wissenschaftlicher
Begründung der Strahlenschutzkommission
– Dosis- und Dosisleistungs-Effektivitätsfaktor (DDREF) –
Nachfolgend wird die Empfehlung mit wissenschaftlicher Begründung der Strahlenschutzkommission (SSK), verabschiedet in der 268. Sitzung der Kommission am 13./14. Februar 2014, bekannt gegeben (Anlage).
RS II 2 - 17027/2
Bundesministerium
für Umwelt, Naturschutz, Bau und Reaktorsicherheit
Dr. Helming
Dosis- und Dosisleistungs-Effektivitätsfaktor (DDREF)
Empfehlung der Strahlenschutzkommission mit wissenschaftlicher Begründung
Verabschiedet in der 268. Sitzung der Strahlenschutzkommission am 13./14. Februar
2014
Vorwort
Hinter dem etwas sperrigen Begriff „Dosis- und Dosisleistungs-Effektivitätsfaktor (DDREF)“ verbirgt sich eine bemerkenswert subtile Größe, die sowohl konzeptionell als auch quantitativ erheblichen Einfluss auf den Strahlenschutz hat. Die Begründung für die Beibehaltung/Modifizierung/Abschaffung eines solchen „Faktors“ beruht daher nicht nur auf Erkenntnissen aus der Strahlenbiologie oder -epidemiologie, sondern wirft auch Fragen im Zusammenhang mit Anforderungen des Strahlenschutzes für die operationelle Umsetzung auf.
Für Zwecke des praktischen Strahlenschutzes geht man davon aus, dass stochastische Strahlenwirkungen einem proportionalen Dosiszusammenhang folgen. Diese Annahme bildet als sogenannte LNT-Hypothese (Linear No Threshold) eines der grundlegenden Konzepte mit äußerst weitreichenden Konsequenzen für den gesamten Strahlenschutz. Strahlenbiologische und strahlenepidemiologische Studien gaben jedoch Hinweise darauf, dass es im Bereich niedriger Dosen Abweichungen von der „reinen“ Linearität und darüber hinaus auch Abhängigkeiten von der Dosisleistung geben könnte. Durch solche Einflüsse würde das auf der Grundlage der LNT-Hypothese ermittelte Strahlenrisiko überschätzt. Aus diesem Grund hatte die International Commission on Radiological Protection (ICRP) bereits in ihren früheren Empfehlungen ein Konzept entwickelt, das alle diese Einflüsse in einem gemeinsamen „Faktor“, dem DDREF, zusammenfasst. Die für den Bereich niedriger Dosen und kleiner Dosisleistungen durch lineare Extrapolation ermittelten Risikokoeffizienten werden durch den DDREF dividiert. In ihrer Empfehlung ICRP 103 bestätigt die ICRP den schon früher eingeführten Wert mit DDREF = 2.
Bereits im Vorfeld der Diskussionen um ICRP 103 beurteilte die Strahlenschutzkommission (SSK) das DDREF-Konzept nicht zuletzt aus konzeptionellen Gründen kritisch und plädierte damals für die Abschaffung des DDREF (gleichbedeutend mit DDREF = 1). Aufgrund der andauernden und teilweise kontroversen Debatten um den DDREF und wegen seiner großen Bedeutung für den Strahlenschutz bat das Bundesministerium für Umwelt, Naturschutz und Reaktorsicherheit (BMU) die Strahlenschutzkommission um eine umfassende Beurteilung der Gesamtproblematik. Zur Bearbeitung des entsprechenden Beratungsauftrags bildete die Strahlenschutzkommission daraufhin eine Arbeitsgruppe, der die folgenden Mitglieder angehörten:
- –
-
Prof. Dr. Michael Atkinson, Helmholtz-Zentrum München
- –
-
Prof. Dr. Joachim Breckow, Technische Hochschule Mittelhessen, Gießen
- –
-
Dr. Günther Dietze, ehem. Physikalisch-Technische Bundesanstalt, Braunschweig
- –
-
Prof. Dr. Jürgen Kiefer, ehem. Justus-Liebig-Universität, Gießen
- –
-
Prof. Dr. Werner Rühm, Helmholtz-Zentrum München.
Bonn, im Juni 2014
| Prof. Dr. Wolfgang-U. Müller Vorsitzender der Strahlenschutzkommission |
Prof. Dr. Joachim Breckow Vorsitzender der Arbeitsgruppe |
Dosis- und Dosisleistungs-Effektivitätsfaktor (DDREF)
Empfehlung der Strahlenschutzkommission
Inhaltsverzeichnis
1 Einleitung
2 Grundsätzliches zum DDREF
3 Strahlenbiologische Studien
4 Strahlenepidemiologische Studien
5 Wissenschaftliche Grundlagen und weitere strahlenschutzrelevante Kriterien zur Beurteilung des DDREF
6 Zusammenfassende Beurteilung
Literatur
1 Einleitung
Eine wesentliche Aufgabe der Strahlenforschung ist es, den Zusammenhang zwischen einer Strahlenexposition und den daraus resultierenden möglichen Strahlenschäden für Menschen quantitativ zu ermitteln. Als Schadensgröße ist von der International Commission on Radiological Protection (ICRP) das sogenannte „Detriment“ (ICRP 2007) definiert worden, eine Größe, in die vor allem das Risiko eingeht, infolge einer Strahlenexposition an Krebs zu erkranken bzw. daran zu sterben. Quantitative Risikoschätzungen erfolgen in der Regel auf der Grundlage epidemiologischer Studien im Bereich relativ hoher Dosen1 und großer Dosisleistungen2. Um zu Aussagen für die im Strahlenschutz wichtigen niedrigen3 Dosis- und kleinen4 Dosisleistungsbereiche zu gelangen, ist man auf Extrapolationen zu niedrigen Dosen und kleinen Dosisleistungen angewiesen, für die nach wie vor keine ausreichenden Daten vorhanden sind, um zuverlässige Risikoangaben machen zu können.
Dosis-Wirkungsbeziehungen aus epidemiologischen Studien beziehen sich jeweils auf eine gegebene Expositionssituation mit bestimmten Dosisleistungen. Dabei wird jeweils die Wirkung betrachtet, die von einer gegebenen Dosis ausgelöst wird. Oft ist die angegebene Dosis nur die in dieser Expositionssituation zeitlich begrenzt aufgetretene zusätzliche Dosis ohne Dosisbeiträge aus anderen Quellen, wie z. B. aus der natürlichen Umgebungsstrahlung. Andere Studien dagegen vergleichen verschiedene Expositionssituationen mit unterschiedlich starker Umgebungsstrahlung, z. B. die Radonstudien. In diesem Fall ist in der Regel die Dosisleistung sehr niedrig, während die Dosis, die über einen langen Zeitraum akkumuliert wird, auch Werte weit über 100 mSv umfasst.
Im Strahlenschutz wird seit vielen Jahren eine lineare Dosis-Wirkungsbeziehung ohne Dosisschwelle angenommen (LNT-Hypothese5). Darüber hinaus wird davon ausgegangen, dass bei niedrigen Dosen das Risiko unabhängig von der zeitlichen Abfolge der Strahlenexposition, d. h. unabhängig von der Dosisleistung ist. Zusätzlich wird angenommen, dass bei niedrigen Dosen und kleinen Dosisleistungen das tatsächliche Risiko um einen gewissen Faktor überschätzt wird, wenn man die Risikowerte von hohen Dosen und großen Dosisleistungen zu niedrigen Dosen und kleinen Dosisleistungen linear extrapoliert. Um dieser vermuteten Überschätzung Rechnung zu tragen, hat die ICRP einen sogenannten „Dosis- und Dosisleistungs-Effektivitätsfaktor“ (DDREF) eingeführt. Risikowerte, die im Wesentlichen aus epidemiologischen Studien an den Atombombenüberlebenden in Hiroshima und Nagasaki ermittelt wurden, werden für die Strahlenschutzanwendungen im Bereich niedriger Dosen und kleiner Dosisleistungen durch diesen DDREF dividiert. In ihrer Empfehlung ICRP 103 (ICRP 2007) bestätigt die ICRP ihre früher entwickelte Argumentation und empfiehlt weiterhin einen DDREF-Wert von 2 für solide Tumoren bei Expositionen mit Photonen (locker ionisierende Strahlung).
Die wissenschaftliche Basis zur Rechtfertigung eines DDREF wird in jüngster Zeit auch in den Fachgremien zunehmend kontrovers diskutiert. So hat die Strahlenschutzkommission bereits 2006 (SSK 2006) empfohlen, den DDREF = 1 zu setzen. UNSCEAR (2010) und die WHO (2013) haben in neueren Publikationen den DDREF nicht angewendet. Vor diesem Hintergrund hat das Bundesministerium für Umwelt, Naturschutz und Reaktorsicherheit (BMU) die SSK beauftragt, den aktuellen Stand der Wissenschaft zu sichten und eine Empfehlung zum DDREF abzugeben.
2 Grundsätzliches zum DDREF
Auf der Grundlage strahlenepidemiologischer Studien ist im Dosisbereich von einigen 100 mSv bei soliden Tumoren ein dosisproportionaler Zusammenhang vergleichsweise gut gesichert. Dies trifft sowohl für akute Strahlenexpositionen mit großer Dosisleistung (hauptsächlich die Studien über die Atombombenüberlebenden [Preston et al. 2003, 2004, 2007]) als auch für chronische Strahlenexpositionen bis zu einem Bereich von etwa 1 Sv mit kleiner Dosisleistung zu. Umstritten ist jedoch der Verlauf dieser Dosis-Wirkungsbeziehung im Bereich niedriger Dosen (unterhalb einiger 10 mSv). In diesem Bereich ist wegen der großen statistischen Unsicherheiten bei epidemiologischen Studien eine zuverlässige Aussage nicht möglich. Deshalb muss auf strahlenbiologische In-vitro- und In-vivo-Untersuchungen zurückgegriffen werden. Aus biologischen Überlegungen heraus scheint es aber durchaus möglich zu sein, dass zwischen Dosis und Strahlenrisiko im Bereich niedriger Dosen ein nicht-linearer Zusammenhang besteht. Auch die Existenz einer Schwellendosis, unterhalb derer kein Strahlenrisiko besteht, kann weder aufgrund epidemiologischer noch aufgrund biologischer Ergebnisse definitiv ausgeschlossen werden.
In vielen zellbiologischen Studien mit hohen Dosen folgt der Dosis-Wirkungszusammenhang nach einer akuten Exposition (großer Dosisleistung) einer Beziehung, die durch eine linear-quadratische Funktion beschrieben werden kann. Grundsätzlich könnten Dosis- und Dosisleistungs-Abhängigkeiten miteinander verknüpft sein.
In klassischen Modellen, beispielsweise bei der Wirkung von hohen Dosen im Bereich der Strahlentherapie, wird dies dahingehend interpretiert, dass sich bei einer Fraktionierung der Exposition die Gesamt-Dosis-Wirkungsbeziehung aus der Aneinanderreihung der Dosis-Wirkungsbeziehungen der Einzelfraktionen ergibt. Dies wird damit begründet, dass Regenerations- und Reparaturprozesse in den Bestrahlungspausen die Zellen wieder in eine Art „Anfangszustand“ versetzen, aus dem heraus sie wieder einer „neuen“ (nicht-linearen) Dosis-Wirkungsbeziehung folgen. Damit wird die Wirkung einer bestimmten Dosis bei fraktionierter Exposition kleiner sein als bei der gleichen Dosis bei einmaliger Exposition. Wird eine derartige Fraktionierung weiter unterteilt in immer mehr Fraktionen (bei gleichbleibender Länge der Pausen zwischen den Expositionen) mit immer kleineren Einzeldosen, so geht dies im Grenzübergang in eine chronische Exposition mit kleiner Dosisleistung über. Dies lieferte die Begründung dafür, dass chronische Expositionen mit kleiner Dosisleistung bei gleicher Dosis zu geringeren Wirkungen führen als akute Expositionen mit großer Dosisleistung. Eine solche Abhängigkeit der Wirkung von der Dosisleistung wird als Dosisleistungs-Effekt bezeichnet und ist für Zellüberleben vielfach nachgewiesen worden.
In dem erwähnten klassischen Modell hängt die Größe des Dosisleistungs-Effekts vom Grad der Nicht-Linearität der Dosis-Wirkungsbeziehung ab. Eine rein lineare Dosis-Wirkungsbeziehung würde nach diesen Vorstellungen zur Folge haben, dass die zeitliche Verteilung einer Exposition keinen Einfluss auf die Wirkung hat und deshalb gar keine Dosisleistungs-Abhängigkeit besteht.
Die oben geschilderte Argumentation ist jedoch nicht zwingend und der ihr zugrunde liegende zelluläre Mechanismus nicht für alle Effekte gültig bzw. nur auf ein gewisses Repertoire an Effekten beschränkt. Es sind durchaus Mechanismen denkbar, deren Wirkung einer nicht-linearen (auch linear-quadratischen) Dosisbeziehung folgen, jedoch durch Schäden zustande kommen, bei denen die betroffenen Zellen nicht nach einer gewissen Erholungsphase in einen Anfangszustand zurückgesetzt werden. In einem solchen Fall besteht trotz nicht-linearer Dosis-Wirkungsbeziehung keine Dosisleistungs-Abhängigkeit. Auf der anderen Seite ist denkbar, dass durch Reparaturmechanismen und andere Prozesse ein molekularer oder zellulärer Schaden zumindest teilweise behoben werden kann, auch wenn die zugrunde liegende Dosis-Wirkungsbeziehung linear verläuft. In diesem Fall kann trotz eines linearen Zusammenhangs durchaus eine Dosisleistungs-Abhängigkeit auftreten.
Falls bei hohen Dosen höhere Risiken pro Dosis bestünden als bei niedrigen Dosen, so würde eine lineare Extrapolation vom hohen in den niedrigen Dosisbereich zu einer Überschätzung des tatsächlichen Risikos führen („Dosis-Effekt“). Analoges gilt für die Extrapolation vom Bereich großer Dosisleistungen zu kleinen Dosisleistungen („Dosisleistungs-Effekt“). Für Zwecke des Strahlenschutzes wird diese mögliche Risikoüberschätzung durch einen gemeinsamen Faktor, den DDREF, berücksichtigt, durch den die Risikokoeffizienten, die bei hohen Dosen und großen Dosisleistungen ermittelt wurden, dividiert werden. Vom Ansatz her liefert das Verfahren zur Ermittlung des DDREF keinen einzelnen „Faktor“ im Sinne eines inhärent konstanten Parameters bei der Abschätzung von Risikokoeffizienten. Vielmehr ist der Wert des DDREF u. a. abhängig von der jeweiligen Dosis und Dosisleistung, von welcher aus in den Bereich niedriger Dosen bzw. kleiner Dosisleistungen extrapoliert wird. Darüber hinaus könnten noch weitere Einflüsse bestehen, wie beispielsweise Abhängigkeiten von der Energie der Strahlung (Trabalka und Kocher 2007). Die Art und Größe all dieser Abhängigkeiten sind im Einzelnen jedoch nur unzureichend bekannt. Daher kommt dem DDREF – welcher Wert ihm auch zugeordnet sein mag – im Strahlenschutz eher eine allgemeine, nicht auf das Detail gerichtete Bedeutung zu. Unter Berücksichtigung all jener Abhängigkeiten werden die Effekte nur in einem konstanten „Faktor“, dem DDREF, zusammengefasst.
Für die Belange des praktischen Strahlenschutzes kam die ICRP im Jahr 2007 zu dem Schluss, „that the adoption of the LNT model combined with a judged value of DDREF provides a prudent basis for practical purposes of radiological protection“ (ICRP 2007). Die ICRP hat im Jahr 2013 eine Task Group eingerichtet, um die Frage des DDREF neu zu diskutieren.
3 Strahlenbiologische Studien
Auf molekularer und zellulärer Ebene (In-vitro-Studien) lässt sich bei verschiedenen Zellsystemen und in Abhängigkeit von den untersuchten Endpunkten eine Vielzahl von linearen und nicht-linearen Effekten beobachten. Über einen großen Dosisbereich betrachtet geht man heute davon aus, dass im Bereich niedriger Dosen (< 100 mGy) andere biologische Mechanismen wirken können als im hohen Dosisbereich. Es ist allerdings nicht bekannt, welche Rolle diese Mechanismen bei niedrigen Dosen letztendlich für die Entstehung von gesundheitlichen Effekten spielen.
Hinsichtlich der Bedeutung zur Beurteilung eines DDREF ergibt sich hieraus kein klares Bild. Während die Anzahl von Doppelstrangbrüchen und anderen strahleninduzierten DNA-Schäden eher linear mit der Dosis zusammenhängen, weisen Chromosomenaberrationen und Reparaturvorgänge zumindest teilweise auch nicht-lineare Dosis-Wirkungskomponenten auf. Abhängigkeiten von der Dosisleistung können bei einer Reihe von Effekten beobachtet werden. Dosis- und Dosisleistungs-Effekte scheinen entgegen früher gemachten Annahmen weitgehend „entkoppelt“ zu sein.
Da die Möglichkeiten der Epidemiologie bei niedrigen Dosen und kleinen Dosisleistungen begrenzt sind, wurde häufig die Ansicht vertreten, dass eine Antwort auf die offenen Fragen durch die Aufklärung grundlegender Mechanismen mit Hilfe von In-vitro-Studien erwartet werden kann. Nach derzeitigem Forschungsstand ist die Lage bei In-vitro-Studien jedoch ambivalent, sodass sie kaum zur Begründung des DDREF herangezogen werden können. Während über lange Zeit davon ausgegangen wurde, dass Dosis-Wirkungskurven für Chromosomenaberrationen, Mutationsinduktion und den Verlust der Koloniebildungsfähigkeit nach Einwirken von locker-ionisierender Strahlung durch eine linear-quadratische Funktion gut beschrieben werden können, ist diese Vorstellung, die letztlich auf mikrodosimetrischen Überlegungen beruhte und eine theoretische Begründung für Nicht-Linearitäten und damit auch für Dosisleistungs-Effekte lieferte, durch neu entdeckte Effekte in Frage gestellt worden.
Selbst wenn generell von nicht-linearen Effekten auf der In-vitro-Ebene ausgegangen werden könnte, ist weitgehend unklar, ob und wie sie in komplexen biologischen Prozessen zusammenwirken und ob und in welcher Weise für die Krebsentstehung Nicht-Linearitäten in vivo „weitergegeben“ werden.
Eine kritische Analyse von vorliegenden In-vivo-Versuchen an Nager-Modell-Organismen liefert auch keine eindeutige Begründung für die Einführung eines Low-Dose Effectiveness Factor (LDEF) oder Dose-Rate Effectiveness Factor (DREF).
Die Studien, auf die zur Stützung des DDREF Bezug genommen wird, untersuchen häufig Endpunkte, wie Tumore der Harderschen Drüse, die es beim Menschen nicht gibt, oder solche Tumoren, die bei Nagern einen anderen Stoffwechsel aufweisen als beim Menschen (Ovarialtumoren). Die ersten Versuche zielten darauf ab, durch sehr große Tierzahlen eine statistisch ausreichende Aussagekraft zu erreichen. Gleichzeitig litten sie jedoch an methodischen Mängeln, wie z. B. unzureichende Berücksichtigung von anderen Todesursachen als die durch die untersuchten strahleninduzierten Tumoren oder nicht-standardisierte Tierhaltungsbedingungen bzw. unterschiedliche Bestrahlungsszenarien. Diese frühen Studien genügen nicht den gegenwärtigen Standards für vergleichende Untersuchungen und ihre Aussagekraft ist deshalb sehr begrenzt.
Im Gegensatz dazu zeigt die Mehrzahl der auf solide Tumoren gerichteten neueren Tierstudien, die unter sorgfältigeren experimentellen Bedingungen durchgeführt wurden, eine Nicht-Linearität der Dosisabhängigkeit der Tumorinzidenz nur oberhalb von 1 Gy bis 2 Gy.
4 Strahlenepidemiologische Studien
Zur Frage eines DDREF spielen epidemiologische Studien eine wichtige Rolle. Werden Dosis-Effekte und Dosisleistungs-Effekte getrennt untersucht, so wird häufig der Low-Dose Effectiveness Factor (LDEF) vom Dose-Rate Effectiveness Factor (DREF) unterschieden. Der Einfluss einer möglicherweise vorhandenen nicht-linearen Dosisabhängigkeit auf den LDEF kann z. B. an den Atombombenüberlebenden untersucht werden. Einflüsse eines möglichen Dosisleistungs-Effekts auf den DREF können dagegen durch einen Vergleich von Personengruppen, die mit kleiner Dosisleistung exponiert wurden (Beschäftigte in der Nuklearindustrie, Bewohner in Gegenden mit erhöhter Hintergrundstrahlung, Bewohner des Tetscha-Gebiets, Aufräumarbeiter in Tschernobyl), mit Personengruppen, die mit großer Dosisleistung exponiert wurden (Atombombenüberlebende), untersucht werden.
In regelmäßigen Abständen wird von der Radiation Effects Research Foundation (RERF) in Japan ein Bericht mit den aktuellsten Ergebnissen der sogenannten Life Span Study (LSS), der epidemiologischen Auswertung der Daten der Atombombenüberlebenden von Hiroshima und Nagasaki veröffentlicht. Die LSS-Untersuchungen stellen die mit Abstand wichtigste Quelle für Risikoschätzungen in der Strahlenepidemiologie dar. Auch für die Diskussion um den DDREF sind diese Studien von zentraler Bedeutung. Da es sich bei der LSS um Expositionen mit großer Dosisleistung handelt, können hier nur Dosis-Effekte (LDEF), jedoch keine Dosisleistungs-Effekte (DREF) untersucht werden. In dem aktuellsten Bericht (Ozasa et al. 2012) ergab bei Berücksichtigung des gesamten verfügbaren Dosisbereichs (Dickdarmdosis < 3 Gy) eine lineare Dosis-Wirkungskurve die beste Anpassung bei den Mortalitätsdaten für solide Tumoren. Dagegen beobachteten die Autoren für den begrenzten Dosisbereich von 0 bis 2 Gy eine signifikante Krümmung der Dosis-Wirkungsbeziehung, die sich mit einer linear-quadratischen Kurve anpassen ließ. Hinweise für eine Dosisschwelle ergaben sich nicht. Wenn die Autoren ihre Analyse auf den Dosisbereich von 0 bis 0,5 Gy bzw. 0 bis 1 Gy beschränkten, ergaben sich kleinere Werte als das ERR6 pro Dosis für den gesamten Dosisbereich. Wenn sich die Analyse auf noch kleinere Dosisbereiche beschränkte (0 bis 0,1 Gy oder kleiner), waren die sich ergebenden ERR-Werte pro Dosis dagegen größer. Dies würde auf eine steilere Dosis-Wirkungsbeziehung bei Dosen unter 0,1 Gy hindeuten, was aber durch die sehr breiten zugehörigen Konfidenz-Intervalle erheblich relativiert wird. Insgesamt lassen diese Analysen in Bezug auf solide Tumoren nicht auf eine bestimmte Form der Dosis-Wirkungskurve bei den Atombombenüberlebenden schließen.
Die meisten Studien an den Beschäftigten in der Nuklearindustrie liefern für die Mortalität durch solide Tumoren einen positiven ERR-Wert pro Dosis, der jedoch statistisch nicht signifikant ist. Eine Studie aus dem Jahre 2005, bei der Daten aus 15 Ländern zusammengefasst wurden, ergab dagegen einen statistisch signifikanten positiven Schätzer für den ERR-Wert pro Dosis, der sich auf einen positiven nicht-signifikanten Wert von 0,58 (95 %-KI7: –0,22 – 1,55) Sv–1 reduzierte, wenn die Daten aus Kanada ausgeschlossen wurden (Cardis et al. 2007). Eine kürzlich veröffentlichte Meta-Analyse aus Japan, in der zum Teil neuere Ergebnisse verwendet wurden, kam ebenfalls zu einem positiven, wenn auch nicht signifikanten Schätzer für den ERR-Wert pro Dosis von 0,14 (95 %-KI: –0,12 – 0,41) Sv–1 (Akiba et al. 2012).
Analysen der Inzidenz solider Tumoren in Gegenden erhöhter natürlicher terrestrischer Strahlung in Kerala in Indien zeigen einen nicht-signifikant negativen ERR-Wert pro Dosis von –0,13 (95 %-KI: –0,58 – 0,46) Gy–1 (Nair et al. 2009), obwohl die mittlere kumulierte Dosis der Studienteilnehmer mit 170 mGy deutlich größer ist als die Dosiswerte, die für die Studien der Nukleararbeiter typisch sind. Ergebnisse einer Studie an der Bevölkerung in Guangdong, einer Gegend mit erhöhter terrestrischer Strahlung in China, ergaben dagegen einen leicht positiven nicht-signifikanten Punktschätzer von 0,19 Gy–1 allerdings mit großem Konfidenz-Intervall (95 %-KI: –1,87 – 3,04 Gy–1) (Tao et al. 2012).
Die aktuellste Studie zur Mortalität der Bevölkerung des Tetscha-Gebiets im Süd-Ural ergab einen signifikant positiven ERR-Wert pro Dosis von 0,92 (95 %-KI: 0,2 – 1,7) Gy–1 (Krestinina et al. 2005, Schonfeld et al. 2013). Einen ähnlichen signifikant positiven ERR-Wert pro Dosis von 1,52 (95 %-KI: 0,20 – 2,85) Gy–1 ergab die aktuellste Analyse der Mortalität der Aufräumarbeiter von Tschernobyl (Ivanov et al. 2006). Bei beiden Kohorten wurde dieses Ergebnis durch die Analyse der Tumor-Inzidenzdaten bestätigt (Tetscha-Gebiet: 1,0 (95 %-KI: 0,3 – 1,9) Gy–1 (Krestinina et al. 2007); Aufräumarbeiter von Tschernobyl: 0,96 (95 %-KI: 0,28 – 1,72) Gy–1 (Ivanov et al. 2009)).
Im Jahre 2009 veröffentlichten Jacob und Mitautoren auf der Basis einer systematischen Literaturrecherche eine Studie, bei der sie alle damals verfügbaren und geeigneten Einzelstudien zur Mortalität oder Inzidenz nach Exposition mit kleinen Dosisleistungen und niedrigen bzw. moderaten kumulierten Dosen berücksichtigten (Jacob et al. 2009). Sie verwendeten die in den Einzelstudien unter der Annahme einer linearen Dosis-Wirkungsbeziehung abgeleiteten Einzelschätzer des zusätzlichen relativen Risikos pro Dosis und verglichen diese mit dem entsprechenden zusätzlichen relativen Risiko pro Dosis, das sie aus den Daten der Studie an den Atombombenüberlebenden ableiteten. Die Autoren stellten also Ergebnisse aus Kohorten mit kleinen Dosisleistungen denen einer Kohorte mit hoher Dosisleistung gegenüber und gewannen so Informationen zum DREF. Das Ergebnis dieser Meta-Studie deutet darauf hin, dass Expositionen mit kleiner Dosisleistung nicht zu einem geringeren Krebsrisiko führen als Expositionen mit großen Dosisleistungen. Demzufolge folgerten die Autoren, dass es auf der Grundlage ihrer Untersuchungen keinen Hinweis auf einen DREF > 1 gibt.
Die Analyse von Jacob et al. (2009) zeigte auch, dass die Ergebnisse von einzelnen Studien mit Vorsicht verglichen und diskutiert werden müssen, weil bei den dort durchgeführten statistischen Analysen der Daten häufig unterschiedliche Annahmen getroffen wurden. Vor diesem Hintergrund schlossen Jacob und Mitautoren in ihrer Meta-Analyse systematisch jede der identifizierten Studien einmal in ihrer gemeinsamen Analyse aus und untersuchten, inwieweit sich bei der Meta-Studie der ERR-Wert pro Dosis dadurch änderte. Sie konnten zeigen, dass dies maximal zu Änderungen im Bereich von 30 % führte (Jacob et al. 2009).
Zusammenfassend lässt sich feststellen, dass die bisher veröffentlichten Ergebnisse epidemiologischer Studien zur Wirkung von Expositionen mit kleiner Dosisleistung in ihrer Gesamtheit keine Hinweise auf eine Abhängigkeit des Tumorrisikos von der Dosisleistung liefern, d. h. einem DREF-Wert von 1 entsprechen. Die meisten dieser Studien erlauben es nicht, aus einer Analyse der Dosis-Wirkungsbeziehung Rückschlüsse auf einen LDEF-Wert zu ziehen. Auch die Studie an den Atombombenüberlebenden, die eine Exposition mit großer Dosisleistung untersucht, erlaubt es wegen der insbesondere bei niedrigen Dosen unterhalb von 100 mGy vorhandenen Unsicherheiten nicht, einen Wert für den LDEF abzuleiten. Somit lässt sich ein spezifischer LDEF-Wert im Bereich von etwa 1 bis 2 – wie er derzeit diskutiert wird – nicht zwingend angeben.
5 Wissenschaftliche Grundlagen und weitere strahlenschutzrelevante Kriterien zur Beurteilung des DDREF
Wissenschaftliche Grundlagen
Der DDREF wurde eingeführt zur Ermittlung von Strahlenrisiken im niedrigen Dosis- und kleinen Dosisleistungsbereich auf der Basis von Untersuchungen bei hohen Dosen bzw. großen Dosisleistungen. Eine Beurteilung, inwieweit die Anwendung eines DDREF gerechtfertigt ist und welcher Wert ihm zugeordnet werden sollte, basiert auf wissenschaftlichen Erkenntnissen über das Strahlenrisiko in unterschiedlichen Dosisbereichen und bei unterschiedlichen Dosisleistungen. Diese Erkenntnisse ergeben sich aus einer Reihe verschiedener Forschungsbereiche und erfordern letztlich eine Abwägung, welche Forschungsergebnisse und welche Kriterien mit welcher Priorität zur Beurteilung herangezogen werden sollen. Im Folgenden werden diese aufgeführt:
- –
-
Strahlenbiologische Untersuchungen an molekularen und zellulären SystemenIn den letzten 50 Jahren bildeten die Ergebnisse von strahlenbiologischen Untersuchungen die wesentliche Basis für die Festlegung eines DDREF, die meist, aber nicht ausschließlich, auf Studien im Bereich von einigen Gy beruhen. Dabei wurden zur Bestimmung von Dosis- und Dosisleistungs-Abhängigkeiten u. a. Untersuchungen an einzelnen Zellen oder Zellkulturen durchgeführt. Diese Daten werden auch heute noch als die wichtigste Quelle für die Rechtfertigung eines DDREF größer als 1 herangezogen, auch wenn diese Studien sich auf hohe Dosen beziehen. Weiterhin ist es offen, ob bzw. wie die Ergebnisse auf die Situation der Tumorinduktion beim Menschen übertragbar sind. Dies gilt insbesondere in Bezug auf neuere Befunde wie zum Beispiel „Bystander-Effekt“, „genomische Instabilität“ und „Adaptive Response“ und deren Bedeutung für die Strahlenwirkung bei niedrigen Dosen und kleinen Dosisleistungen. Ein Teilaspekt bei diesen Untersuchungen ist die Frage, ob Dosis-Effekte (Abweichung von einer linearen Dosis-Wirkungsbeziehung) und Dosisleistungs-Effekte gekoppelt sind oder ob sie unabhängig voneinander betrachtet werden müssen.
- –
-
Strahlenbiologische Untersuchungen an TierenTierexperimente gehen in die Diskussion für die Festlegung eines DDREF ein. Diese werden überwiegend an Mäusen oder Ratten durchgeführt, wobei im Einzelnen eine Reihe von verschiedenen Endpunkten (Lebenszeitverkürzung, Tumorinzidenz, Tumormortalität usw.) beobachtet wird. Wenngleich auch hier offen bleibt, inwieweit die Ergebnisse auf die Tumorinduktion beim Menschen übertragbar sind, entspricht die Bestrahlung eines ganzen Organismus eher der Situation beim Menschen als die Bestrahlung von einzelnen Zellen. Es ist jedoch zu beachten, dass bei Untersuchungen an Tieren das Studiendesign (Endpunkte) und die zahlreichen Einflussparameter bei der Durchführung der Studien das Ergebnis erheblich beeinflussen und eine generelle Aussage zum DDREF erschweren.
- –
-
Epidemiologische StudienEpidemiologische Daten sind ebenfalls eine wichtige Quelle zur Ermittlung eines DDREF, insbesondere da sie sich direkt auf Krebserkrankungen beim Menschen beziehen. Auch epidemiologische Studien erlauben die Untersuchung von Dosis-Effekten (LDEF) und Dosisleistungs-Effekten (DREF) sowie die Frage, ob diese unabhängig voneinander sind. Während Dosis-Wirkungsbeziehungen im Prinzip bei der Untersuchung einer einzelnen exponierten Kohorte (z. B. die mit unterschiedlichen Dosen exponierten Überlebenden in Hiroshima und Nagasaki) ermittelt werden können (LDEF), sind zur Untersuchung des Dosisleistungs-Effekts (DREF) normalerweise vergleichende Studien an verschiedenen Populationen notwendig, die mit unterschiedlichen Dosisleistungen exponiert wurden. Die Aussagekraft gegenwärtiger epidemiologischer Studien zum Risiko von strahlenbedingten Krebserkrankungen ist bei Expositionen im Dosisbereich von einigen 10 mSv im Gegensatz zum Bereich oberhalb von 100 mSv gering. Studien im Bereich kleiner Dosisleistungen erfordern in der Regel lange Expositions- bzw. Beobachtungsdauern. Dies erschwert belastbare Aussagen zur Wirkung kleiner Dosisleistungen. In den letzten Jahren sind allerdings eine Reihe von Studien im mittleren Dosis- und Dosisleistungsbereich hinzugekommen, die eine genauere Beurteilung erlauben. Durch die Zusammenfassung von Einzelstudien in Meta-Analysen kann die Situation weiter verbessert werden.
- –
-
Mechanistische strahlenbiologische ModelleUm zu Aussagen für den im Strahlenschutz wichtigen Bereich niedriger Dosen und kleiner Dosisleistungen zu gelangen, ist man auf Extrapolationen von hohen Dosisbereichen angewiesen. Solche Extrapolationen erfolgen häufig auf der Grundlage mathematisch formulierter mechanistischer Modelle. Diese spielen bei der Interpretation experimenteller und epidemiologischer Daten eine erhebliche Rolle. Dazu zählt beispielsweise die Annahme einer rein linearen oder einer linear-quadratischen Dosis-Wirkungsbeziehung. Darüber hinaus ist es wegen des Hintergrundrisikos bei der Auswertung epidemiologischer Daten wichtig, ob ein multiplikatives, additives oder gemischtes Risikomodell zur Anwendung kommt. Auch die Frage, in welchem Umfang Alters- und Geschlechtsabhängigkeiten (bis hin zu individuellen Merkmalen) des Strahlenrisikos zu berücksichtigen sind, beeinflusst die Abschätzung von Risikokoeffizienten. Bei der Frage, welches Modell vorliegende experimentelle bzw. epidemiologische Daten am besten beschreibt, spielt die Unsicherheit der Daten eine erhebliche Rolle. In der Regel sind die Daten im Bereich der niedrigsten betrachteten Dosen und kleinsten Dosisleistungen mit den größten Unsicherheiten behaftet. Dies schränkt die Entscheidungsmöglichkeiten, welches Modell die Daten am besten beschreibt, stark ein und führt zu erheblichen Unsicherheiten bei der modellabhängigen Ermittlung eines DDREF.
Kriterien zu Anforderungen des Strahlenschutzes für die operationelle Umsetzung
Eine Beurteilung, ob der derzeitige im Strahlenschutz zur Abschätzung des Strahlenrisikos allgemein angewandte DDREF-Wert – wie in der Vergangenheit bereits mehrfach geschehen – geändert werden sollte, basiert nicht ausschließlich auf den genannten wissenschaftlichen Erkenntnissen im engeren Sinne, sondern bezieht maßgeblich auch weitere Kriterien ein, die sonstige wichtige Aspekte des Strahlenschutzes und die praktische Umsetzung betreffen. Eine Beurteilung lediglich auf der Basis wissenschaftlicher Grundlagen und Kriterien wird der Bedeutung und Funktion des DDREF nicht gerecht. Daher werden zusätzlich zu den wissenschaftlichen Erkenntnissen auch die folgenden Kriterien zur Beurteilung herangezogen:
- –
-
Einfluss von UnsicherheitenDie Unsicherheiten von ermittelten Risikowerten und einem daraus abgeleiteten DDREF sind erheblich und führen dazu, dass man lediglich einen Bereich von DDREF-Werten (zur Debatte stehende Werte etwa zwischen 1 und 2) angeben kann, der mit den experimentellen und epidemiologischen Daten verträglich ist. Die Überlegungen zur Änderung des bisher verwendeten DDREF-Werts von 2 dürfen deshalb den Gesichtspunkt der Unsicherheit nicht außer Acht lassen. Es ist zu entscheiden, ob die gegenüber früher verbesserte Datenlage (und damit reduzierte Unsicherheit) heute noch Anlass zur Einführung eines DDREF geben würde (wenn es einen solchen noch nicht gäbe) oder ob die Unsicherheiten nach wie vor so erheblich sind, dass für eine Abschaffung eines bereits bestehenden DDREF nicht genügend Aussagekraft besteht.
- –
-
Umsetzung in den praktischen StrahlenschutzKontinuität, Konsens, Nachvollziehbarkeit und Akzeptanz sind ein hohes Gut im Strahlenschutz. Häufige Wechsel von Konzepten und Vorschriften können insbesondere bei der Umsetzung in die Praxis zu Verunsicherungen führen, die im Strahlenschutz kontraproduktiv sind, und daher, wenn immer möglich, vermieden werden sollten. Änderungen sollten nur dann angestrebt werden, wenn sie hinreichend wissenschaftlich begründbar sind und wenn damit tatsächlich eine deutliche Verbesserung des Strahlenschutzes beispielsweise im Sinne einer besseren Schutzwirkung bzw. eines größeren Nutzen-Risiko-Verhältnisses erzielt werden kann.
- –
-
Internationale EinbindungDie gegenwärtige Konzeption des Strahlenschutzes ist das Resultat eines weltweiten und andauernden historischen Prozesses. Der seit jeher bemerkenswert hohe Grad an internationaler Übereinstimmung in den Strahlenschutzregelungen ist auch das Ergebnis der ständigen Bemühung um einen möglichst breiten internationalen Konsens. Dieser weitreichende Konsens umfasst auch die Einschätzungen über die wissenschaftliche Basis des Strahlenschutzes, wie beispielsweise die Erkenntnisse über die Strahlenbiologie und Strahlenwirkung oder Fragen der Konservativität im Strahlenschutz. Eine aktive Beteiligung an der internationalen Konsensbildung ist ein wichtiger Aspekt.
- –
-
Konsequenzen für GrenzwertfestsetzungDer Strahlenschutz mit seinen konzeptionellen „Grundsäulen“ Rechtfertigung, Optimierung und Begrenzung ist so robust ausgelegt, dass quantitative Schwankungen einer der implementierten Größen (z. B. des DDREF, der Wichtungsfaktoren) nicht notwendigerweise zu Änderungen der Grenzwertsetzung führen müssen, könnten allerdings Anlass zu Diskussionen hierüber geben. Es würde dabei zwangsläufig das Problem berührt, dass die Festlegung der Grenzwerte für beruflich strahlenexponierte Personen sich auf Argumentationslinien stützt, für die der Wert des Strahlenrisikos, und damit der DDREF, eine weit größere Rolle spielt als bei dem Grenzwert für die allgemeine Bevölkerung. Bei ihr wird die Festlegung des Grenzwerts im Wesentlichen damit begründet, dass er im Schwankungsbereich der natürlichen Strahlenexposition liegt und im Bereich von 1 mSv keine Risikoaussagen gemacht werden können.
- –
-
RisikokommunikationDas Strahlenrisiko ist in der öffentlichen Wahrnehmung geprägt von besonderer Sensibilität. Dabei wird die öffentliche Diskussion bezüglich der Wirkung von Strahlung und der Höhe der Strahlenrisiken häufig von Fehleinschätzungen bestimmt. Daher muss bei jeder Neubewertung eine sorgfältige und umfassende Kommunikation gewährleistet sein.Voraussetzung für eine erfolgreiche Kommunikation ist Vertrauen der Öffentlichkeit in die Glaubwürdigkeit der wissenschaftlichen Gremien. Glaubwürdigkeit kann nicht zuletzt dadurch erreicht werden, dass Hinweise, die auf höhere Risiken hindeuten, aufgegriffen und ausführlich diskutiert werden. Die Diskussion und Kommunikation muss in einem Kontext und in einer Form erfolgen, der es der Öffentlichkeit erlaubt, den Stellenwert neuer wissenschaftlicher Erkenntnisse beurteilen zu können.8
6 Zusammenfassende Beurteilung
Eine Aussage zum DDREF auf der Grundlage strahlenbiologischer Untersuchungen an Zellkulturen führt zu keinem einheitlichen Bild. Auf molekularer und zellulärer Ebene (In-vitro-Studien) lässt sich eine Vielzahl von linearen und nicht-linearen Effekten beobachten. Während Effekte auf „früher“ Wirkungsebene, wie beispielsweise Energiedeposition, Doppelstrangbrüche und andere strahleninduzierte DNA-Schäden, eher linear mit der Dosis zusammenhängen, scheinen komplexere, „spätere“ Wirkungen, wie Chromosomen-Aberrationen, Reparaturvorgänge und andere Effekte, auf nachfolgender Wirkungsebene zumindest teilweise nicht-lineare Dosis-Wirkungskomponenten aufzuweisen. Es kommt hinzu, dass im Bereich niedriger Dosen andere biologische Mechanismen wirken als im hohen Dosisbereich. Abhängigkeiten von der Dosisleistung können bei einer Reihe von Effekten beobachtet werden. Es gibt keine eindeutigen Hinweise für einen Zusammenhang zwischen Dosis- und Dosisleistungs-Effekten. Sie können demzufolge als weitgehend „entkoppelt“ voneinander betrachtet werden.
Die Wirkungen bei Untersuchungen an Tieren zeigen große Variabilität. Eindeutige Dosis-Wirkungszusammenhänge im Bereich niedriger Dosen oder Dosisleistungs-Abhängigkeiten lassen sich nicht ermitteln. Insgesamt ergeben sich jedoch bei Tierexperimenten wenig Hinweise auf eine generelle Abweichung von einer linearen Dosis-Wirkungsbeziehung oder auf eine generelle Dosisleistungs-Abhängigkeit.
Bisher galten strahlenbiologische Experimente als Hauptstütze zur Argumentation für einen DDREF-Wert größer als 1. Nicht-Linearitäten in Dosis-Wirkungsbeziehungen und Dosisleistungs-Abhängigkeiten werden nach wie vor auch in aktuellen Studien beobachtet. Je nach biologischem Endpunkt findet man eine große Bandbreite von unterschiedlichen Dosis-Effektabhängigkeiten.
Gegenwärtig ergibt ein Vergleich der aktuellsten Ergebnisse von epidemiologischen Studien bei kleinen und großen Dosisleistungen in seiner Gesamtheit keinen Hinweis auf eine Abhängigkeit des Tumorrisikos von der Dosisleistung, also auf einen DREF-Wert größer 1. Die meisten der zu kleinen Dosisleistungen durchgeführten Studien verwenden bei der Analyse eine lineare Dosis-Wirkungsbeziehung. Deshalb können daraus keine Rückschlüsse auf eine Form der Dosis-Wirkungskurve und damit auf einen bestimmten LDEF-Wert gezogen werden. In der aktuellsten Studie an den Atombombenüberlebenden, die eine Untersuchung der Wirkung großer Dosisleistungen darstellt, lässt sich nicht eindeutig zwischen verschiedenen Formen der Dosis-Wirkungsbeziehung (z. B. linear oder linear-quadratisch) unterscheiden, sodass sich auch gegenwärtig daraus kein LDEF-Wert zwingend ableiten lässt.
Mechanistische Modelle können im Prinzip die Möglichkeit bieten, einen funktionellen Zusammenhang zwischen Wirkung und Dosis abzuleiten. Sie spielen daher bei der Extrapolation vom Bereich hoher Dosen zu niedrigen Dosen eine große Rolle. Ursprünglich war auch der linear-quadratische Dosis-Wirkungszusammenhang als mechanistisches Modell entworfen worden und bildete damit ein starkes Indiz für einen DDREF > 1. Auch wenn dieses Modell mittlerweile kaum mehr den Anspruch erhebt, einen Wirkungsmechanismus realistisch zu beschreiben, hat es doch einen Teil seiner Bedeutung behalten.
Mechanistische Modelle bilden jedoch in der Regel nur einen Ausschnitt aus dem äußerst komplexen und noch weitgehend unbekannten Wirkungsablauf zwischen Primärereignis (Ionisation) und Endpunkt (Krebserkrankung) ab. Es ist kaum davon auszugehen, dass der Gesamtablauf des Prozesses der Kanzerogenese durch eines dieser Modelle, wenn es über einen bloßen Datenfit hinausgehen soll, beschrieben werden kann. Daher können auch Modellbildungen nur eingeschränkt zur Entscheidung herangezogen werden, welcher Wert für einen DDREF angemessen ist.
Unsicherheiten haben maßgeblichen Einfluss auf die Begründung für einen DDREF. Keines der wissenschaftlichen Kriterien reicht für sich allein aus, einen eindeutigen Wert für den DDREF zu liefern. Vielmehr führen die vielfältigen Variabilitäten der verschiedenen Studienansätze und ihrer Ergebnisse sowie deren Unsicherheiten dazu, dass ein DDREF-Wert lediglich auf einen Wertebereich unterhalb von 2 beschränkt werden kann. Die Auswertung der wissenschaftlichen Erkenntnisse erlaubt jedoch keine weitere Eingrenzung des DDREF.
Wie in Kapitel 2 erläutert wurde, ist der DDREF eine in ihrer Bedeutung und in ihrer Funktion sehr subtile konzeptionelle Größe. Tatsächlich spricht bei Anwendung der wissenschaftlichen Kriterien einiges dafür, dass auf der Grundlage der heutigen wissenschaftlichen Erkenntnisse und der großen Unsicherheit des Strahlenrisikos bei niedrigen Dosen ein solcher Faktor nicht eingeführt würde, wenn er nicht bereits bestünde. Die Gewährleistung einer möglichst großen Kontinuität im Strahlenschutz führt dann zu der Frage, ob eine nach aktueller wissenschaftlichen Beurteilung weniger starke Evidenz für einen DDREF dessen Abschaffung mit den daraus möglichen resultierenden Konsequenzen ausreichend rechtfertigen kann oder ob die Unsicherheiten einen nicht entscheidbaren und daher zur Debatte stehenden Wertebereich zwischen 1 und 2 zulassen. Darüber hinaus ist zu bemerken, dass das konzeptionelle Gebäude des Strahlenschutzes auf den drei Grundprinzipien „Rechtfertigung“, „Optimierung“ und „Begrenzung“ und damit in seinen wesentlichen Elementen nicht auf der genauen Kenntnis des Strahlenrisikos bei niedrigen Dosen beruht.
Vor dem Hintergrund des oben skizzierten Kontinuitätskriteriums erfordert die Umsetzung in den praktischen Strahlenschutz eine besonders sorgfältige Abwägung, ob der DDREF-Wert geändert werden soll. Eine derartige Abwägung sollte nur im internationalen Konsens erfolgen.
Auf der Grundlage aktueller wissenschaftlicher Erkenntnisse sieht die SSK keine ausreichende Begründung mehr für den im Strahlenschutz verwendeten DDREF. Wenn allerdings aus wissenschaftlichen Gründen eine Verkleinerung bzw. Abschaffung des DDREF erwogen wird, so muss begründet werden, dass dieses wissenschaftliche Motiv ausreichend ist, insbesondere dann, wenn nicht eindeutig und nachvollziehbar angegeben werden kann, was das für die Verbesserung des Strahlenschutzes bedeutet. Andererseits ist zu prüfen, inwieweit eine mögliche Unterschätzung des Krebsrisikos bei niedrigen Dosen und kleinen Dosisleistungen mit dem Vorsorgeprinzip im Strahlenschutz verträglich ist.
Für die SSK hat die wissenschaftliche Basis ihrer Stellungnahmen und Empfehlungen einen hohen Stellenwert. Nach Auffassung der SSK stellt eine möglichst große wissenschaftliche Objektivität und das permanente Bemühen um die Berücksichtigung aller aktuellen Forschungsergebnisse die Voraussetzung dafür dar, das notwendige Vertrauen der Bevölkerung in die Bewertungen der SSK zu erhalten und zu verstärken. Dies sieht die SSK auch bei einer Anpassung des DDREF auf der Basis neuer wissenschaftlicher Erkenntnisse. Über die Verpflichtung zur wissenschaftlichen Objektivität hinaus sieht die SSK ihre Aufgabe jedoch auch darin, Probleme in der öffentlichen Wahrnehmung zu beachten und ihnen durch eine intensive und andauernde Kommunikation Rechnung zu tragen.
Die für den Strahlenschutz wichtigsten Größen sind der mit einer Strahlenexposition verbundene Schaden (Krebsentstehung und genetische Veränderungen) und dessen Eintrittswahrscheinlichkeit. Als Maß hierfür gilt das sogenannte „Detriment“ (gesundheitlicher Schaden), eine gewichtete Schadenswahrscheinlichkeit, in die u. a. die Risikokoeffizienten (unter Einbeziehung eines DDREF) eingehen (siehe Kapitel 1). Das Detriment beinhaltet aber auch eine Reihe weiterer Parameter, wie z. B. die Überlebenswahrscheinlichkeit, die Lebensqualität und der Verlust an Lebenserwartung. Diese Parameter unterliegen einer zeitlichen Entwicklung. Verbesserte Lebensbedingungen und Fortschritte in der Medizin könnten beispielsweise dazu führen, dass sich die Überlebenswahrscheinlichkeit bei einer Krebserkrankung erhöht, die Lebensqualität verbessert und der Verlust an Lebenserwartung verkleinert. Alle diese Parameter müssen bei der weiteren Bewertung der gesundheitlichen Auswirkungen einer bestimmten Strahlenexposition berücksichtigt werden. Eine isolierte Betrachtung des Risikokoeffizienten bzw. des DDREF wird der Gesamtsituation nicht gerecht.
Im Zusammenhang mit der Entscheidung für eine Änderung des DDREF spielt dieser Gesichtspunkt insofern eine Rolle, dass beide Effekte in komplexer Weise zusammenwirken und dies eine kompensatorische Tendenz aufweisen könnte: Die Abschaffung des DDREF würde für sich gesehen zu einer Erhöhung des strahleninduzierten Detriments führen, die Anpassung der oben genannten Parameter an die aktuellen Statistiken könnte dagegen zu einer Erniedrigung des Detriments führen.
Empfehlung der Strahlenschutzkommission
Auf der Grundlage aktueller wissenschaftlicher Erkenntnisse sieht die SSK keine ausreichende Begründung mehr für den im Strahlenschutz verwendeten DDREF.
Die SSK empfiehlt aufgrund der in diesem Bericht aufgeführten Bewertungen, den DDREF an die neueren Erkenntnisse anzupassen und gegebenenfalls abzuschaffen.
Aufgrund seiner Bedeutung für die Risikobewertung und die Konsequenzen für den Strahlenschutz empfiehlt die SSK darüber hinaus, im Zuge dieser Anpassung auch alle anderen Parameter, die in das Detriment, d. h. in die Angabe des Strahlenschadens eingehen, an den aktuellen wissenschaftlichen Stand anzupassen.
Die SSK hält eine internationale Abstimmung in diesen Fragen für dringend erforderlich und empfiehlt daher, ihre Einschätzung in die internationale Diskussion einzubringen.
Literatur
| Akiba und Mizuno 2012 | Akiba S und Mizuno S. The third analysis of cancer mortality among Japanese nuclear workers, 1991-2002: estimation of excess relative risk per radiation dose. J Radiol Prot. 2012;32:73-83 |
| Cardis et al. 2007 | Cardis E, Vrijheid M, Blettner M, Gilbert E, Hakama M, Hill C, Howe G, Kaldor J, Muirhead CR, Schubauer-Berigan M, Yoshimura T, Bermann F, Cowper G, Fix J, Hacker C, Heinmiller B, Marshall M, Thierry-Chef I, Utterback D, Ahn YO, Amoros E, Ashmore P, Auvinen A, Bae JM, Bernar J, Biau A, Combalot E, Deboodt P, Diez Sacristan A, Eklöf M, Engels H, Engholm G, Gulis G, Habib RR, Holan K, Hyvonen H, Kerekes A, Kurtinaitis J, Malker H, Martuzzi M, Mastauskas A, Monnet A, Moser M, Pearce MS, Richardson DB, Rodriguez-Artalejo F, Rogel A, Tardy H, Telle-Lamberton M, Turai I, Usel M, Veress K. The 15-Country Collaborative Study of Cancer Risk among Radiation Workers in the nuclear industry: estimates of radiation-related cancer risks. Radiat Res. 2007;167:396-416 |
| ICRP 2007 | International Commission on Radiological Protection (ICRP). The 2007 Recommendations of the International Commission on Radiological Protection. Publication 103, Annals of the ICRP 37 (2-4), Pergamon Press, Oxford. 2007 |
| Ivanov et al. 2009 | Ivanov VK, Gorsky AI, Kashcheev VV, Maksioutov MA, Tumanov KA. Latent period in induction of radiogenic solid tumors in the cohort of emergency workers. Radiat Environ Biophys. 2009;48(3):247-252 |
| Jacob et al. 2009 | Jacob P, Rühm W, Walsh L, Blettner M, Hammer G, Zeeb H. Cancer risk of radiation workers larger than expected? Occup Environ Med. 2009 Dec 66;(12):789-796. doi: 10.1136/oem.2008.043265. Epub 2009 Jun 30 |
| Krestinina et al. 2005 | Krestinina LY, Preston DL, Ostroumova EV, Degteva MO, Ron E, Vyushkova OV, Startsev NV, Kossenko MM, Akleyev AV. Protracted radiation exposure and cancer mortality in the Techa River Cohort. Radiat Res. 2005;164:602-611 |
| Krestinina et al. 2007 | Krestinina LY, Davis F, Osroumova EV, Epifanova SB, Degteva MO, Preston DL, Akleyev AV. Solid cancer incidence and low-dose-rate radiation exposure in the Techa River cohort: 1956-2002. Int J Epid. 2007;36:1038-1046 |
| Nair et al. 2009 | Nair RRK, Rajan B, Akiba S, Jayalekshmi P, Nair MK, Gangadharan P, Koga T, Morishima H, Nakamura S, Sugahara T. Background radiation and cancer incidence in Kerala, India – Karunagaplpally cohort study. Health Phys. 2009;96:55-66 |
| Ozasa et al. 2012 | Ozasa K, Shimizu Y, Suyama A, Kasagi F, Soda M, Grant EJ, Sakata R, Sugiyama H, Kodama K. Studies of the mortality of atomic bomb survivors, Report 14, 1950-2003: An overview of cancer and noncancer diseases. Radiat Res. 2012;177:229-243 |
| Schonfeld et al. 2013 | Schonfeld SJ, Krestinina LY, Epifanova S, Degteva MO, Akleyev AV, Preston DL. Solid Cancer Mortality in the Techa River Cohort (1950-2007). Radiat Res. 2013;179:183-189 |
| SSK 2006 | Strahlenschutzkommission (SSK). Comments on the 2006 Draft of the ICRP Recommendations. Stellungnahme der Strahlenschutzkommission. Verabschiedet in der 209. Sitzung der Strahlenschutzkommission am 5. September 2006 |
| Tao et al. 2012 | Tao Z, Akiba S, Zha Y, Sun Q, Zou J, Li J, Liu Y, Yuan Y, Tokonami S, Morishoma H, Koga T, Nakamura S, Sugahara T, Wei L. Cancer and non-cancer mortality among inhabitants in the high background radiation area of Yangjiang, China (1979-1998). Health Phys. 2012;102:173-181 |
| Trabalka und Kocher 2007 | Trabalka JR und Kocher DC. Energy dependence of dose and dose-rate effectiveness factor for low-LET radiations: Potential importance to estimate of cancer risks and relationship to biological effectiveness. Health Phys. 2007;93(1):17-27 |
| UNSCEAR 2010 | United Nations Scientific Committee on the Effects of Atomic Radiation (UNSCEAR) 2010. Report to the General Assembly, includes Scientific Report: Summary of low-dose radiation effects on health. 2011 |
| WHO 2013 | World Health Organization (WHO). Health risk assessment from the nuclear accident after the 2011 Great East Japan Earthquake and Tsunami, based on a preliminary dose estimation. 2013 |
Dosis- und Dosisleistungs-Effektivitätsfaktor (DDREF)
Wissenschaftliche Begründung zur Empfehlung der Strahlenschutzkommission
Inhaltsverzeichnis
1 Einleitung
1.1 Fragestellung
1.2 Hintergrund
Literatur
2 Grundsätzliches zum DDREF
2.1 Zusammenhang mit Dosis-Wirkungsbeziehungen
2.2 Zusammenhang zwischen Dosis- und Dosisleistungs-Effekten
2.3 Zusammenhang mit LET und Energie
2.4 Fazit
Literatur
3 Strahlenbiologische Studien
3.1 In-vitro-Studien
3.1.1 Dosisabhängigkeiten
3.1.2 Dosisleistungsabhängigkeiten
3.1.3 Fazit
Literatur
3.2 In-vivo-Studien
3.2.1 Tierstudien zum DDREF
3.2.2 Der Einfluss von „Non-Target-Processes“ auf die Form der Dosis-Wirkungskurven und damit auch auf den DDREF
3.2.3 Studienarten
3.2.3.1 Der Einfluss des Studiendesigns auf die Krebsinzidenz, die Latenzzeiten und die Mortalität
3.2.3.2 Der Einfluss der Altersverschiebung bei Expositionen mit chronischer Bestrahlung
3.2.3.3 Unterschiede in der Art der Dosisapplikation
3.2.3.4 Datenauswertung
3.2.3.5 Spontane im Vergleich zu induzierten Tumoren
3.2.3.6 Die Vermengung der Parameter Lebenszeitverkürzung und Krebs als Todesursache
3.2.4 Mögliche Fehlschlüsse bei Langzeit-Tierstudien
3.2.4.1 Qualität der Dosimetrie für die Tierexperimente
3.2.4.2 Fluktuationen in der Hintergrundrate
3.2.4.3 Schwankungen (Drift) bei den verwendeten Mäusestämmen
3.2.4.4 Geschlecht
3.2.4.5 Jahreszeiten
3.2.4.6 Umgebung
3.2.4.7 Hygiene
3.2.4.8 Konkurrierende Todesursachen
3.2.4.9 Histopathologische Auswertung und Relevanz des Tumortyps in den Tierversuchen in Bezug auf den Menschen
3.2.5 Fazit
Literatur
4 Strahlenepidemiologische Studien
4.1 Fazit
Literatur
5 Wissenschaftliche Grundlagen und weitere strahlenschutzrelevante Kriterien zur Beurteilung des DDREF
6 Zusammenfassende Beurteilung
Anhang A zu Kapitel 3.2 „In-vivo-Studien“
A.1 Studien zum Effekt der Dosis
A.1.1 Studien des Oak Ridge National Laboratory (ORNL) zur Lebenszeitverkürzung von RFM-Mäusen (ORNL-1, ORNL-2) (Storer et al. 1979)
A.1.2 Studien des Oak Ridge National Laboratory (ORNL) zur Krebsinduktion bei RFM-Mäusen (ORNL-3) (Ullrich und Storer 1979a, b, c)
A.1.3 Studien des Oak Ridge National Laboratory (ORNL) mit BALB/c-Mäusen (ORNL-4) (Ullrich und Storer 1979c)
A.1.4 Zweite Studie des Oak Ridge National Laboratory (ORNL) zur akuten Exposition von BALB/c-Mäusen (ORNL-5) (Ullrich 1983)
A.1.5 MRC-Studie über die Induktion von myeloischer Leukämie in CBA/H-Mäusen durch akute Röntgenbestrahlung (MRC-1) (Mole et al. 1983)
A.1.6 JANUS-Studien des Argonne National Laboratory (ANL) zu Tumorinzidenzen (JANUS-1) (Grahn et al. 1992)
A.1.7 ENEA-Studie über Kanzerogenese bei niedrigen Dosen (ENEA-1) (Covelli et al. 1988)
A.1.8 Überlebensstudie des SCK-CEN für akute Röntgenexposition (SCK-1) (Maisin et al. 1996)
A.2 Studien zum Effekt der Dosisleistung
A.2.1 Die JANUS-Studien (JANUS-2) (Lorenz 1955, Grahn 1994)
A.2.2 Studien des Oak Ridge National Laboratory (ORNL) zur Lebenszeitverkürzung von RFM-Mäusen (ORNL-6) (Storer et al. 1979)
A.2.3 Studien des Oak Ridge National Laboratory (ORNL) über protrahierte Bestrahlungen von RFB-Mäusen (ORNL-7) (Ullrich und Storer 1979c)
A.2.4 Studien des Oak Ridge National Laboratory (ORNL) über protrahierte Bestrahlungen von BALB/c-Mäusen (ORNL-8) (Ullrich und Storer 1979c)
A.2.5 JANUS-Studien des Argonne National Laboratory (ANL) zum Einfluss der Dosisrate auf die Tumorinzidenz (JANUS-3) (Grahn et al. 1992)
A.2.6 MRC-Studie über myeloische Leukämie in der CBA/H-Maus (MRC-2) (Mole und Mayor 1983)
A.2.7 Lebenszeit-Studie der Japanischen „Electrical Power Association“ Tokyo (JEPA-1) (Ina und Sakai 2004, 2005)
A.2.8 Lebenszeit-Studien des Institute of Ecological Studies Rokkasho (IES-1) (Tanaka et al. 2003, Tanaka et al. 2007)
Literatur
Anhang B zu Kapitel 4 „Strahlenepidemiologische Studien“
Epidemiologische Studien im Hinblick auf das Risiko strahleninduzierter solider Tumoren – Bedeutung für den DDREF
B.1 Einleitung
B.2 Studie zur Mortalität der Atombombenüberlebenden (Ozasa et al. 2012)
B.3 Übersichtsartikel
B.3.1 Die Studie von Akiba und Mizuno 2012
B.3.2 Die Studie von Ogata 2011
B.3.3 Die Studie von Jacob et al. 2009
B.3.4 Beschäftigte in der Nuklearindustrie von 15 Ländern (Cardis et al. 2005, 2007)
B.4 Einzelstudien – Mortalität
B.4.1 Bewohner in Guangdong, China (Tao et al. 2012)
B.4.2 Beschäftigte in der japanischen Nuklearindustrie (Akiba und Mizuno 2012)
B.4.3 Beschäftigte bei der Firma Rocketdyne/Atomics International (Boice et al. 2011)
B.4.4 Beschäftigte bei der französischen „Atomic Energy Commission“ und der Firma AREVA (Metz-Flamant et al. 2011)
B.4.5 Beschäftigte bei der „Electricité de France“ (Laurent et al. 2010)
B.4.6 Dritte Analyse von strahlenexponierten Arbeitern in Großbritannien (Muirhead et al. 2009)
B.4.7 Beschäftigte am Oak Ridge National Laboratory – Mortalität (Stayner et al. 2007)
B.4.8 Hanford Arbeiter (Wing und Richardson 2005)
B.4.9 Beschäftigte in der Nuklearindustrie in den USA (Howe et al. 2004)
B.4.10 Beschäftigte in der Nuklearindustrie in Kanada (Zablotska et al. 2004)
B.4.11 Anwohner an der Tetscha (Krestinina et al. 2005)
B.4.12 Aufräumarbeiter nach dem Unfall von Tschernobyl (Ivanov et al. 2006)
B.5 Einzelstudien – Inzidenz
B.5.1 Bewohner in Kerala, Indien (Nair et al. 2009)
B.5.2 Aufräumarbeiter nach dem Unfall von Tschernobyl (Ivanov et al. 2009)
B.5.3 Dritte Analyse von strahlenexponierten Arbeitern in Großbritannien (Muirhead et al. 2009)
B.5.4 Anwohner an der Tetscha (Krestinina et al. 2007)
Literatur
Abbildungsnachweis
Tabellennachweis
1 Einleitung
1.1 Fragestellung
Eine wesentliche Aufgabe der Strahlenforschung ist es, den Zusammenhang zwischen einer Strahlenexposition und den daraus resultierenden möglichen Strahlenschäden für Menschen quantitativ angeben zu können. Als Schadensgröße ist von der International Commission on Radiological Protection (ICRP) das sogenannte „Detriment“ (ICRP 103) definiert worden, eine Größe, in die vor allem das Risiko eingeht, infolge einer Strahlenexposition an Krebs zu erkranken bzw. daran zu sterben. Neuere Erkenntnisse zeigen, dass auch Herz-Kreislauferkrankungen mit in die Betrachtung einbezogen werden sollten (SSK 2012). Das ist aber nicht das Thema der vorliegenden Arbeit, sondern hier liegt der Schwerpunkt auf dem Dosis- und Dosisleistungs-Effektivitätsfaktor (DDREF), einem weiteren Aspekt, der eine Rolle spielt. Quantitative Risikoschätzungen erfolgen in der Regel auf der Grundlage epidemiologischer Studien im Bereich relativ hoher Dosen9 und großer Dosisleistungen10. Um zu Aussagen für die im Strahlenschutz wichtigen niedrigen11 Dosis- und kleinen12 Dosisleistungsbereiche zu gelangen, ist man auf Extrapolationen zu niedrigen Dosen und kleinen Dosisleistungen angewiesen, für die nach wie vor keine ausreichenden Daten vorhanden sind, um zuverlässige Risikoangaben machen zu können.
Dosis-Wirkungsbeziehungen aus epidemiologischen Studien beziehen sich jeweils auf eine gegebene Expositionssituation mit bestimmten Dosisleistungen. Dabei wird jeweils die Wirkung betrachtet, die von einer gegebenen Dosis ausgelöst wird. Oft ist die angegebene Dosis nur die in dieser Expositionssituation zeitlich begrenzt aufgetretene zusätzliche Dosis ohne Dosisbeiträge aus anderen Quellen, wie z. B. aus der natürlichen Umgebungsstrahlung. Andere Studien dagegen vergleichen verschiedene Expositionssituationen mit unterschiedlich starker Umgebungsstrahlung, z. B. die Radonstudien. In diesem Fall ist in der Regel die Dosisleistung sehr niedrig, während die Dosis, die über einen langen Zeitraum akkumuliert wird, auch Werte weit über 100 mSv umfasst.
Im Strahlenschutz wird seit vielen Jahren eine lineare Dosis-Wirkungsbeziehung ohne Dosisschwelle angenommen (LNT-Hypothese13). Darüber hinaus wird davon ausgegangen, dass bei niedrigen Dosen das Risiko unabhängig von der zeitlichen Abfolge der Strahlenexposition, d. h. unabhängig von der Dosisleistung ist. Zusätzlich wird angenommen, dass bei niedrigen Dosen und kleinen Dosisleistungen das tatsächliche Risiko um einen gewissen Faktor überschätzt wird, wenn man die Risikowerte von hohen Dosen und großen Dosisleistungen zu niedrigen Dosen und kleinen Dosisleistungen linear extrapoliert. Um dieser vermuteten Überschätzung Rechnung zu tragen, hat die ICRP einen sogenannten „Dosis- und Dosisleistungs-Effektivitätsfaktor“ (DDREF) eingeführt. Risikowerte, die im Wesentlichen aus epidemiologischen Studien an den Atombombenüberlebenden in Hiroshima und Nagasaki ermittelt wurden, werden für die Strahlenschutzanwendungen im Bereich niedriger Dosen und kleiner Dosisleistungen durch diesen DDREF dividiert. In ihrer Empfehlung ICRP 103 (2007) bestätigt die ICRP ihre früher entwickelte Argumentation und behält einen DDREF-Wert von 2 für solide Tumoren für Expositionen mit Photonen und Elektronen (Niedrig-LET14-Strahlung) bei. Die SSK hatte sich bei ihren Kommentaren zu ICRP 103 dieser Argumentation allerdings nicht angeschlossen und plädierte für einen DDREF = 1, also für die Anwendung des „reinen“ LNT-Modells. Die SSK stützte sich dabei in der Hauptsache auf eine fehlende Evidenz für eine Risikoerniedrigung bei niedrigen Dosen und auf konzeptionelle Begründungen (SSK 2006).
Der DDREF stellt mit all seinen Facetten eine außerordentlich subtile Größe dar und ist im eigentlichen Sinn kein einzelner „Faktor“. Er beinhaltet vielmehr mehrere Einflussgrößen, die lediglich für Strahlenschutzzwecke zu einer einzelnen und damit praktikableren Größe zusammengefasst sind.
Die wissenschaftliche Basis zur Rechtfertigung des DDREF wird in jüngster Zeit auch in den Fachgremien zunehmend kontrovers diskutiert. Dies hat das BMU zum Anlass genommen, die SSK zu beauftragen, den aktuellen Stand der Wissenschaft zu diesem Themenbereich zu sichten und eine Stellungnahme zum DDREF abzugeben. Aufgrund der Vielschichtigkeit des Problems hat das Bundesministerium für Umwelt, Naturschutz und Reaktorsicherheit (BMU) bewusst darauf verzichtet, konkretere Schwerpunkte zu nennen bzw. Teilaspekte im Beratungsauftrag hervorzuheben, sondern bittet um eine „Stellungnahme und Bewertung der Gesamtthematik zur Strahlenwirkung im Bereich der beruflichen Strahlenexposition“.
1.2 Hintergrund
Im Rahmen der drei Grundprinzipien im Strahlenschutz (Rechtfertigung von Anwendungen, die mit ionisierender Strahlung verbunden sind, Optimierung von Strahlenschutzmaßnahmen und Begrenzung der Exposition) ist insbesondere bei der Festlegung von Dosisgrenzwerten die Kenntnis des Zusammenhangs zwischen Strahlenrisiko und Dosis eine wesentliche Voraussetzung. Deshalb ist die historische Entwicklung bei den Grenzwerten unmittelbar verbunden mit den jeweiligen Kenntnissen über die gesundheitlichen Schäden einer Person infolge einer Exposition durch ionisierende Strahlung. Dabei handelt es sich im hier betrachteten Bereich niedriger bzw. mittelhoher Dosen (< 1 Gy) im Wesentlichen um stochastisch auftretende Schäden (Inzidenz bzw. Mortalität infolge von Tumoren und vererbbaren Schäden), bei denen die Wahrscheinlichkeit für das Auftreten eines Effekts mit der Stärke der Exposition, d. h. der applizierten Dosis, korreliert ist. Quantitativ wird dies durch den Risikokoeffizient angegeben, d. h. dem Quotienten aus der Wahrscheinlichkeit einer gesundheitlichen Schädigung der betrachteten Person und der verursachenden Dosis. Im Rahmen dieses Berichts interessieren insbesondere die Abhängigkeit dieses Risikokoeffizienten von der applizierten Dosis und der Dosisleistung und der daraus abgeleitete Risikokoeffizient für Expositionen mit niedriger Dosis und kleiner Dosisleistung.
Bereits in den 40er und 50er Jahren des letzten Jahrhunderts hat man bei Untersuchungen mit hohen Dosen an Zellkulturen, Pflanzen und Tieren festgestellt, dass bei vielen beobachteten stochastischen Effekten nach einer Exposition die Wirkung von ionisierender Strahlung – und damit das Strahlenrisiko – nicht-linear mit der applizierten Dosis korreliert ist und zusätzlich auch von der Dosisleistung abhängt.
In zahlreichen Publikationen der Internationalen Strahlenschutzkommission (ICRP) und von UNSCEAR, dem wissenschaftlichen Komitee der UN, ist die Entwicklung in der Forschung auf dem Gebiet der Wirkung ionisierender Strahlung dokumentiert. Dazu zählen auch Aussagen zur Frage der Dosis- und Dosisleistungs-Abhängigkeit des Risikokoeffizienten und seines Werts im Bereich niedriger Dosen und kleiner Dosisleistungen.
Im ersten UNSCEAR-Report (UNSCEAR 1958) findet man nur wenige Angaben zur Dosis- bzw. Dosisleistung-Abhängigkeit eines Risikokoeffizienten für karzinogene Wirkungen. In Chapter VII (Summary and Conclusions) heißt es:
„(36)… Our knowledge of the biological effects of low radiation levels is meagre because of experimental difficulties and the lengthy observations necessary to obtain results in this field. At present opinions as to the possible effects of low radiation levels must be based only on extrapolations from experience with high doses and dose rates.“
Im zweiten UNSCEAR-Report (UNSCEAR 1962) wurde auf der Basis der „2-Treffer Theorie“ (Lea 1955) und vorliegender Daten aus sehr unterschiedlichen experimentellen Untersuchungen an Zellen und Tieren eine exponentielle bzw. linear-quadratische Dosis-Wirkungskurve vermutet:
| I = α ⋅ D + β ⋅ D2 | (2.1) |
Im niedrigen Dosisbereich (D <<α/β) dominiert eine lineare Dosis-Wirkungsbeziehung ohne Schwelle, bei der der quadratische Term keine Rolle spielt.
Im dritten UNSCEAR-Report (UNSCEAR 1964), Annex B „Radiation Carcinogenesis in Man“ findet man dazu dann folgenden Absatz, allerdings keine quantitativen Angaben über die vermutete Überschätzung des Risikos bei niedriger Dosis:
„(17) In most cases in which extrapolation to low doses has been attempted a linear relationship between dose and effect has been assumed. A discussion of the use of the linear hypothesis can be found in the 1962 report. It should be noted that the assumption of linearity is the only one which allows the use of mean doses in estimating risks. In general, the assumption of a linear dose-incidence relationship at low-dose levels is likely to result in an overestimate of the degree of risk.“
Für lange Zeit gab diese Aussage zur Überschätzung bei niedrigen Dosen die herrschende Meinung wieder, wobei insbesondere aus Tierversuchen auch eine Dosisleistungs-Abhängigkeit der stochastischen Wirkung bekannt war. Dies findet seinen Ausdruck auch in den NCRP-, ICRP- und UNSCEAR-Berichten in den 70er Jahren.
Aus der Auswertung von Tierexperimenten (somatische Effekte, Krebsinduktion, Lebenszeitverkürzung) wird ein Bereich für einen DREF-Wert (Dose Rate Effectiveness Factor) von 2 bis 10 abgeschätzt (UNSCEAR 1977). Dazu wird allerdings bemerkt:
„Because of the complexity and wide spectrum of the tumorigenic responses to radiation in the experimental animal, however, there appears to be no rigorously-defensible approach to deriving satisfactory DREF´s for the human being, for either single tumor types or for all tumors collectively. Thus, the NCRP is reluctant at this time to go beyond providing a range of factors within which a single factor for the total yield of tumors in man after exposure of the whole body probably would lie. The DREF range is 2 to 10, when the actual absorbed dose is 20 rad (0,2 Sv) or less, or the dose rate is 5 rad per year (0,05 Sv/y) or less.“
In den 80er Jahren hat man bei Betrachtung von Mutationen, Chromosomenschäden und der Induktion von einigen Tumoren das linear-quadratische Modell favorisiert und der UNSCEAR-Report von 1986 (UNSCEAR 1986) kommt für locker ionisierende Strahlung zu der Angabe eines Faktors von 1,5 bis 3 zwischen dem Risikokoeffizienten im Bereich 0,5 Gy bis 1,5 Gy und dem bei 10 mGy. Ein ähnlicher Faktor wird auch für das Verhältnis bei großer und kleiner Dosisleistung abgeschätzt. Andererseits wird bei anderen Tumoren auch von einer linearen Dosis-Wirkungsbeziehung berichtet und letztlich wird kein generell gültiger Reduktionsfaktor genannt. In dem folgenden UNSCEAR-Report (UNSCEAR 1988) wird wie im NCRP-Bericht von 1980 ein Wertebereich für einen DREF von 2 bis 10 angegeben.
In ICRP 60 (ICRP 1991) wird im Annex B, B53 ff. die Situation bezüglich eines Reduktionsfaktors ausführlich diskutiert und ein „Dose and Dose Rate Effectiveness Factor“ (DDREF) benannt, so wie er auch heute noch definiert wird. Auf der Basis theoretischer Modelle, zahlreicher tierexperimenteller Untersuchungen zur Krebsinzidenz und Lebenszeitverkürzung, einiger klinischer Daten und der begrenzten epidemiologischen Information aus Hiroshima und Nagasaki (Life Span Study, LSS) sowie unter Kenntnisnahme anderer vorliegender Berichte und Einschätzungen (UNSCEAR, BEIR, NUREG, US NIH) wurde von der ICRP für Niedrig-LET-Strahlung zur Umrechnung von Risikokoeffizienten, die im Bereich hoher Dosen und großer Dosisleistungen ermittelt worden sind, auf niedrige Dosen und kleine Dosisleistungen ein DDREF-Wert von 2 empfohlen. Er wurde als relativ konservativer Wert angesehen, und es wurde angemerkt, dass der empfohlene Wert sich ändern könne, wenn in Zukunft bessere Informationen vorliegen.
In ICRP 99 aus dem Jahr 2005 zu Fragen der Extrapolation des Risikokoeffizienten zu niedrigen Dosen (ICRP 2005) wurde der DDREF-Wert von 2 erneut bestätigt, allerdings wurde auch betont, dass nach den neuesten LSS-Studien (Pierce und Preston 2000) ein Wert > 2 nicht mehr konsistent wäre.
In den Reports von UNSCEAR 2006 und UNSCEAR 2010 werden umfangreiche Risikorechnungen mit unterschiedlichen Dosis-Wirkungsbeziehungen dokumentiert. In der überwiegenden Anzahl der tabellierten Ergebnisse ist das Krebsrisiko pro Dosis bei 10 mSv ähnlich wie bei 1 Sv. Es wird berichtet, dass bei epidemiologischen Untersuchungen nicht eindeutig zwischen einer linearen und linear-quadratischen Dosis-Wirkungsbeziehung entschieden werden kann (UNSCEAR 2006: „… are consistent with a linear or linear-quadratic dose-response relationship“, UNSCEAR 2010: „The dose-response relationship for mortality at low doses … may be described by both a linear and a curvilinear function.“). Es ergeben sich jedoch keine eindeutigen Hinweise, dass eine linear-quadratische Funktion notwendig ist, um die Daten zu beschreiben.
Das BEIR VII-Komitee (BEIR 2006) hat die experimentellen Daten zur Frage des DDREF ebenfalls neu analysiert und einen Wertebereich von 1,1 bis 2,3 mit einer Bayeschen Analyse abgeleitet. Dem Komitee erschien der abgeleitete Wertebereich als unplausibel eng. In den Rechnungen wurde deshalb ein größerer Unsicherheitsbereich verwendet. Unter Berücksichtigung der statistischen Verteilung dieser Daten hat das Komitee einen DDREF-Wert von 1,5 vorgeschlagen.
Im Jahr 2007 hat die ICRP in ihren allgemeinen Empfehlungen zum Strahlenschutz, ICRP 103 (ICRP 2007), ihre Empfehlung zum DDREF 1991 nicht geändert und unter Berücksichtigung der erheblichen Unsicherheiten weiterhin einen DDREF-Wert von 2 für solide Tumoren empfohlen. In Annex A heißt es in diesem Zusammenhang:
„A dose and dose-rate effectiveness factor (DDREF) of 2 recommended in Publication 60 (ICRP 1991) should be retained for radiological protection purposes; the effect of introducing the possibility of a low-dose threshold for cancer risk is judged to be equivalent to that of an uncertain increase in the value of DDREF.“
Die SSK hat sich bei ihren Kommentaren zu ICRP 103 dieser Argumentation jedoch nicht angeschlossen und plädierte für einen DDREF = 1, also für die Anwendung des reinen LNT-Modells bei der Extrapolation von hohen zu niedrigen Dosen und kleinen Dosisleistungen (SSK 2006).
Betrachtet man die historische Entwicklung bei der Ermittlung von allgemeinen Risikokoeffizienten zum Strahlenrisiko, so muss man ebenfalls berücksichtigen, dass sich im Laufe der Zeit der Begriff des Schadens (Detriment) und damit des Strahlenrisikos geändert hat. Während früher für die Angabe der Risikokoeffizienten im Wesentlichen das Mortalitätsrisiko betrachtet wurde, bezieht man sich heute überwiegend auf die Wahrscheinlichkeit der Krebsinzidenz, wobei zusätzlich noch das Mortalitätsrisiko sowie die Beeinträchtigung der Lebensqualität und die Lebenszeitverkürzung berücksichtigt werden. Auch andere Erkrankungen, wie z. B. die des Herz-Kreislaufsystems, werden gegenwärtig diskutiert und müssen nach neueren Erkenntnissen möglicherweise zukünftig in die Betrachtung mit einbezogen werden (SSK 2012). In die Angabe der Risikokoeffizienten geht also nicht nur der DDREF ein, sondern auch noch eine Reihe anderer Faktoren, die sich aus neuen medizinischen Entwicklungen oder wissenschaftlichen Erkenntnissen ergeben und ebenfalls Änderungen unterworfen sein können.
Literatur
| BEIR 2006 | Committee to Assess Health Risks from Exposure to Low Levels of Ionizing Radiation, Board on Radiation Effects, Research Division on Earth and Life Studies, National Research Council of the National Academies. Health risks from exposure to low levels of ionizing radiation. BEIR VII – Phase 2. United States National Academy of Sciences. National Academy Press, Washington DC. 2006 |
| ICRP 1991 | International Commission on Radiological Protection (ICRP). The 1990 Recommendations of the International Commission on Radiological Protection. Publication 60, Annals of the ICRP 21 (1-3). Pergamon Press, Oxford. 1991 |
| ICRP 2005 | International Commission on Radiological Protection (ICRP). Low-dose Extrapolation of Radiation-related Cancer Risk. Publication 99, Annals of the ICRP 35 (4). Pergamon Press, Oxford. 2005 |
| ICRP 2007 | International Commission on Radiological Protection (ICRP). The 2007 Recommendations of the International Commission on Radiological Protection. Publication 103, Annals of the ICRP 37 (2-4). Pergamon Press, Oxford. 2007 |
| Lea 1955 | Lea DE. Actions of Radiations on Living Cells. 2nd. Ed. University Press, Cambridge. 1955 |
| NCRP 1980 | National Council on Radiological Protection (NCRP). Influence of dose and its distribution in time on dose-response relationships for low-LET radiations. NCRP Report 64, NCRP, Washington DC. 1980 |
| Pierce und Preston 2000 | Pierce DA und Preston DL. Radiation-related cancer risk at low doses among atomic bomb survivors. Radiat Res. 2000;154:178-186 |
| SSK 2006 | Strahlenschutzkommission (SSK). Comments on the 2006 Draft of the ICRP Recommendations. Stellungnahme der Strahlenschutzkommission. Verabschiedet in der 209. Sitzung der Strahlenschutzkommission am 5. September 2006 |
| SSK 2012 | Strahlenschutzkommission (SSK). Herz-Kreislauferkrankungen nach zulässigen beruflichen Strahlenexpositionen. Stellungnahme der Strahlenschutzkommission. Verabschiedet in der 256. Sitzung der Strahlenschutzkommission am 19./20. April 2012 |
| UNSCEAR 1958 | United Nations Scientific Committee on the Effects of Atomic Radiation (UNSCEAR): Sources and Effects of Ionizing Radiation. General Assembly Official Records, 13th Session, Chapter VII. United Nations, New York, NY. 1958 |
| UNSCEAR 1962 | United Nations Scientific Committee on the Effects of Atomic Radiation (UNSCEAR): Sources and Effects of Ionizing Radiation. General Assembly Official Records, 17th Session, Chapter VII. United Nations, New York, NY. 1962 |
| UNSCEAR 1964 | United Nations Scientific Committee on the Effects of Atomic Radiation (UNSCEAR): Sources and Effects of Ionizing Radiation. General Assembly Official Records, 19th Session, Chapter III. United Nations, New York, NY. 1964 |
| UNSCEAR 1977 | United Nations Scientific Committee on the Effects of Atomic Radiation (UNSCEAR): Sources and Effects of Ionizing Radiation. Report to the General Assembly with Annexes, Annex G. United Nations, New York, NY. 1977 |
| UNSCEAR 1986 | United Nations Scientific Committee on the Effects of Atomic Radiation (UNSCEAR): Genetic and Somatic Effects of Ionizing Radiation. Report to the General Assembly with Annexes, Annex B. United Nations, New York, NY. 1986 |
| UNSCEAR 1988 | United Nations Scientific Committee on the Effects of Atomic Radiation (UNSCEAR): Sources, Effects and Risks of Ionizing Radiation. Report to the General Assembly with Annexes. United Nations, New York, NY. 1988 |
| UNSCEAR 2006 | United Nations Scientific Committee on the Effects of Atomic Radiation (UNSCEAR): 2006. Report to the General Assembly, with scientific annexes, Volume I: Report to the General Assembly, Scientific Annex A: Epidemiological studies of radiation and cancer. 2006 |
| UNSCEAR 2010 | United Nations Scientific Committee on the Effects of Atomic Radiation (UNSCEAR): 2010. Report to the General Assembly, includes Scientific Report: Summary of low-dose radiation effects on health. 2011 |
2 Grundsätzliches zum DDREF
Eines der Hauptziele im Strahlenschutz ist die Begrenzung des durch ionisierende Strahlung verursachten Risikos, einen gesundheitlichen Schaden zu erleiden. Bei niedrigen Dosen sind dies die stochastischen Wirkungen (Verursachung von Krebs und vererbbaren Schäden). Risiken – sowohl individuell als auch kollektiv – sind jedoch einer Messung bzw. einer messtechnischen Überwachung nicht unmittelbar zugänglich. Daher wird im gegenwärtig praktizierten Strahlenschutz eine Risikobegrenzung durch die Begrenzung der (messtechnisch erfassbaren oder berechenbaren) Dosis und durch die Festlegung von Dosisgrenzwerten umgesetzt. Dabei wird unterstellt, dass die verschiedenen Dosisdefinitionen (z. B. die Organdosis oder die effektive Dosis) für spezifische Anwendungen ein jeweils sinnvolles Maß für das Strahlenrisiko darstellen, d. h. dass eine eindeutige Beziehung zwischen Dosis und Risiko besteht. Die Aufklärung solcher Dosis-Wirkungszusammenhänge ist daher zentrales Element der Strahlenforschung.
2.1 Zusammenhang mit Dosis-Wirkungsbeziehungen
In der Regel basieren Dosis-Wirkungsabschätzungen auf Auswertungen epidemiologischer Studien über Expositionen im Dosisbereich oberhalb von etwa 50 mSv bis 100 mSv. Risiken im Bereich des Grenzwerts für die berufliche Lebenszeitdosis (400 mSv) lassen sich hiermit sowohl für Expositionen mit kleiner als auch großer Dosisleistung unmittelbar abschätzen. Um auf Aussagen im für den Strahlenschutz wichtigen Bereich unterhalb von einigen 10 mSv zu kommen, ist man jedoch auf Extrapolationen vom hohen in den niedrigen Dosisbereich angewiesen. Diese Extrapolation geschieht unter Einbeziehung strahlenbiologischer Ergebnisse, mechanistischer Studien und biophysikalischer Modelle, auf deren Grundlage Wirkungsmechanismen aufgedeckt werden und in die Beschreibung der (qualitativen) Form einer Dosis-Wirkungsbeziehung im Bereich niedriger Dosen einfließen. Als Extrapolationsmodell kommt häufig das sogenannte „Linear-quadratische Modell“ zur Anwendung (siehe Kapitel 2.2 und 2.3). Während es früher im Wesentlichen mit mikrodosimetrischen Überlegungen begründet wurde, die sich heute nicht mehr in vollem Umfang aufrechterhalten lassen, wird es heute als eine einfache mathematische Beschreibung nicht-linearer Abhängigkeiten verwendet. Die extrapolierten Dosis-Wirkungsbeziehungen liefern die Risikokoeffizienten für den Bereich niedriger Dosen (z. B. ICRP 2007).
In den vergangenen Jahrzehnten ist immer wieder versucht worden, Dosis-Wirkungsbeziehungen für die verschiedenen stochastischen Effekte, vor allem aber für Krebserkrankungen, durch eine Vielzahl verschiedener Ansätze zu bestimmen. Eine Extrapolation in den Bereich niedriger Dosen nur auf der Basis epidemiologischer Daten lässt dabei keine eindeutige Entscheidung über die Form der Dosis-Wirkungsbeziehung zu. Ein großer Teil der kontroversen Diskussion über das Risiko niedriger Dosen ionisierender Strahlung ist auf diese Tatsache zurückzuführen. Doch auch unter Einbeziehung mechanistischer Studien auf biophysikalischer, molekular- und zellbiologischer Ebene sowie tierexperimenteller Studien sind Aussagen zum Strahlenrisiko im niedrigen Dosisbereich nur unzureichend belastbar (siehe Kapitel 4).
Um dennoch zu quantitativen Aussagen für Zwecke des Strahlenschutzes, beispielsweise zur Formulierung von Dosisgrenzwerten, zu kommen, macht sich die ICRP, so wie weltweit nahezu alle anderen Strahlenschutzgremien, das Konzept der sogenannten LNT-Hypothese zu eigen, die unterstellt, dass die Wirkung von ionisierender Strahlung im niedrigen Dosisbereich linear mit der Dosis zunimmt und keinen Dosisschwellenwert aufweist (ICRP 2007, Tubiana et al. 2006, Brenner und Sachs 2006, Breckow 2006, Shore 2009). Auf der LNT-Hypothese beruhen wesentliche Konzepte des Strahlenschutzes (ALARA-Prinzip, Rechtfertigungsprinzip, Konzept der effektiven Dosis und vieles mehr), so wie sie gegenwärtig nahezu weltweit realisiert werden.
Kernpunkt der Diskussion ist die Beziehung zwischen Dosis und Wirkung in Bezug auf die strahleninduzierte Kanzerogenese beim Menschen. Auf der Grundlage strahlenepidemiologischer Studien ist im Dosisbereich von einigen 100 mSv bei soliden Tumoren ein dosisproportionaler Zusammenhang vergleichsweise gut gesichert. Dies trifft sowohl für akute Strahlenexpositionen mit großer Dosisleistung (hauptsächlich die Studien über die Atombombenüberlebenden [Preston et al. 2003, 2004, 2007]) als auch für chronische Strahlenexpositionen bis zu einem Bereich von etwa 1 Sv mit kleiner Dosisleistung zu. Umstritten ist jedoch der Verlauf dieser Dosis-Wirkungsbeziehung im Bereich niedriger Dosen (unterhalb einiger 10 mSv). In diesem Dosisbereich ist es mit epidemiologischen Mitteln wegen der großen statistischen Unsicherheiten grundsätzlich nicht möglich, den Kurvenverlauf hinreichend genau zu ermitteln. Aus biologischen Überlegungen heraus erscheint es aber durchaus als möglich, dass zwischen Dosis und Strahlenrisiko im Bereich niedriger Dosen ein nicht-linearer Zusammenhang besteht. Auch die Existenz einer Schwellendosis, unterhalb derer kein Strahlenrisiko besteht, kann weder aufgrund epidemiologischer noch aufgrund biologischer Ergebnisse definitiv ausgeschlossen werden.
2.2 Zusammenhang zwischen Dosis- und Dosisleistungs-Effekten
In vielen zellbiologischen Studien mit hohen Dosen ist der Dosis-Wirkungszusammenhang nach einer akuten Exposition (große Dosisleistung) nicht-linear und kann häufig durch eine linear-quadratische Beziehung beschrieben werden. Grundsätzlich können Dosis- und Dosisleistungs-Abhängigkeiten miteinander verknüpft sein.
In klassischen Modellen, beispielsweise bei der Wirkung von hohen Dosen im Bereich der Strahlentherapie, wird dies dahingehend interpretiert, dass sich bei einer Fraktionierung der Exposition die Gesamt-Dosis-Wirkungsbeziehung aus der Aneinanderreihung der Dosis-Wirkungsbeziehungen der Einzelfraktionen ergibt (Abbildung 2.1). Dies wird damit begründet, dass Regenerations- und Reparaturprozesse in den Bestrahlungspausen die Zellen wieder in eine Art „Anfangszustand“ versetzen, aus dem heraus sie wieder einer „neuen“ (linear-quadratischen) Dosis-Wirkungsbeziehung folgen. Damit wird die Wirkung einer bestimmten Dosis bei Fraktionierung kleiner sein als bei der gleichen Dosis bei einmaliger Exposition. Wird eine derartige Fraktionierung weiter unterteilt in immer mehr Fraktionen (einschließlich der Pausen) mit immer kleineren Einzeldosen, so geht dies im Grenzübergang in eine chronische Exposition mit kleiner Dosisleistung über (Abbildung 2.1). Dies liefert die Begründung dafür, dass chronische Expositionen mit kleiner Dosisleistung bei gleicher Dosis zu geringeren Wirkungen führen als akute Expositionen mit großer Dosisleistung. Eine solche Abhängigkeit der Wirkung von der Dosisleistung wird als Dosisleistungs-Effekt bezeichnet und ist für Zellüberleben vielfach nachgewiesen worden.
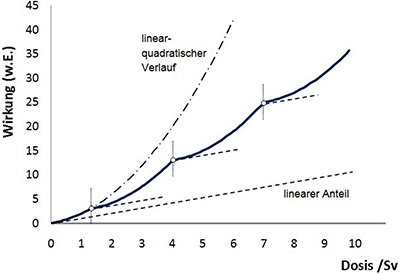
Abbildung 2.1: Dosisleistungs-Effekt: Unter Zugrundelegung einer linear-quadratischen Dosis-Wirkungsbeziehung (Gl. (2.1) und Gl. (2.2), hier mit α/β = 1 Sv) ergibt sich bei Fraktionierung, d. h. bei Exposition mit mehreren Einzeldosen, eine kleinere Wirkung (durchgezogene Linie) als die Wirkung durch eine einmalige Exposition mit gleicher Dosis (punkt-gestrichelte Linie). Im Grenzübergang zu sehr vielen Fraktionen folgt die Wirkung dem linearen Anteil (gestrichelte Linie) des linear-quadratischen Verlaufs.
In dem erwähnten klassischen Modell hängt die Größe des Dosisleistungs-Effekts vom Grad der Nicht-Linearität (bzw. im linear-quadratischen Modell von der Größe des quadratischen Anteils) ab. Eine rein lineare Dosis-Wirkungsbeziehung geht nach diesen Vorstellungen davon aus, dass die zeitliche Verteilung einer Exposition keinen Einfluss auf die Wirkung hat und deshalb gar keine Dosisleistungs-Abhängigkeit besteht.
Im linear-quadratischen Modell wird die Steigung der Dosis-Wirkungsbeziehung bei niedrigen Dosen durch den linearen Term (häufig mit α ⋅ D bezeichnet, siehe Gleichung (2.1)) bestimmt (Abbildung 2.2). Die Wirkung bei chronischen Expositionen (kleine Dosisleistungen) wird gemäß obiger Begründung (vgl. Abbildung 2.1) durch diesen Term bestimmt. Bei höheren Dosen gewinnt zunehmend der quadratische Term (β ⋅ D2) an Bedeutung. Der Dosiswert, bei der der lineare und der quadratische Term gleich groß sind, heißt α/β-Wert. Er ist ein Maß für die Nicht-Linearität einer Dosis-Wirkungsbeziehung. Je größer dieser Wert ist, desto linearer ist der Dosis-Wirkungszusammenhang und desto kleiner ist im Modell von Abbildung 1 der Unterschied in der Wirkung zwischen akuter und chronischer Exposition. Im Grenzfall zu sehr großen α/β-Werten geht eine linear-quadratische Beziehung in eine lineare Beziehung über und der Dosisleistungs-Effekt verschwindet (siehe oben). Somit bedeutet auf der Grundlage dieser Überlegungen die LNT-Annahme bei niedrigen Dosen inhärent auch die Unabhängigkeit der Wirkung von der Dosisleistung in diesem Dosisbereich.
Die oben geschilderte Argumentation ist jedoch nicht zwingend und der ihr zugrunde liegende zelluläre Mechanismus nicht für alle Effekte gültig bzw. nur auf ein gewisses Repertoire an Effekten beschränkt. Es sind durchaus Mechanismen denkbar, deren Wirkung einer nicht-linearen (auch linear-quadratischen) Dosisbeziehung folgen, jedoch durch Schäden zustande kommen, die sich in einer Weise akkumulieren, dass die betroffenen Zellen nicht nach einer gewissen Erholungsphase in einen Anfangszustand zurückgesetzt werden. In einem solchen Fall besteht trotz nicht-linearer Dosis-Wirkungsbeziehung keine Dosisleistungs-Abhängigkeit. Auf der anderen Seite ist denkbar, dass durch Reparaturmechanismen und andere Prozesse ein molekularer oder zellulärer Schaden zumindest teilweise behoben werden kann, auch wenn die zugrunde liegende Dosis-Wirkungsbeziehung linear verläuft. In diesem Fall kann trotz eines linearen Zusammenhangs durchaus eine Dosisleistungs-Abhängigkeit auftreten.
Von vielen molekularen und zellulären Strahlenwirkungen sind die Dosis-Wirkungsbeziehungen, teilweise bis in den Dosisbereich von 1 mSv, bekannt (siehe Kapitel 3.1). Es finden sich hierbei sowohl Effekte mit linearen Abhängigkeiten (z. B. Doppelstrangbrüche), mit linear-quadratischen Abhängigkeiten (z. B. Chromosomen-Aberrationen) als auch noch andere nicht-lineare Abhängigkeiten (z. B. Adaptive Response, Bystander-Effekt, Apoptose). Das Wissen über deren Zusammenwirken im gesamten, äußerst komplexen kanzerogenen Prozess ist jedoch noch zu gering, um belastbare Aussagen über dessen Gesamt-Dosis-Wirkungsverlauf im Bereich niedriger Dosen und eventuelle Dosisleistungs-Abhängigkeiten hieraus ableiten zu können. Auch Aussagen über mögliche Zusammenhänge von Dosis und Dosisleistung sind unbestimmt. Dies ist einer der Gründe dafür, dass die ICRP und andere Gremien nur einen Faktor (DDREF) zur Berücksichtigung von Dosis- und Dosisleistungs-Effekten eingeführt haben und nicht den Versuch unternehmen, die jeweiligen Effekte getrennt zu betrachten und separate Faktoren hierfür anzugeben (ICRP 2007, BEIR 2006).
Die Abhängigkeit des Strahlenrisikos nur von der Dosisleistung ist auf der Grundlage von epidemiologischen Studien untersucht worden (Jacob et al. 2009). In einer Meta-Analyse aus 12 Studien wurden die abgeleiteten Risikokoeffizienten aus Studien mit mittleren Dosen und kleinen Dosisleistungen den Ergebnissen aus den Studien über die Atombombenüberlebenden von Hiroshima und Nagasaki (Life Span Study, LSS) gegenübergestellt, die großen Dosisleistungen ausgesetzt waren (siehe Kapitel 4). In dieser Studie wurde auf der Grundlage der LNT-Annahme für alle Studien der Einfluss verschiedener Dosisleistungen auf die Risikoschätzungen untersucht. Dieser Ansatz erlaubt also die separate Diskussion über einen „Dosis-Effektivitätsfaktor“ einerseits und einen „Dosisleistungs-Effektivitätsfaktor“ andererseits (Jacob et al. 2009).
Die Terminologie zur Beschreibung der verschiedenen Dosis- und Dosisleistungs-Abhängigkeiten ist recht vielfältig und nicht immer einheitlich. In der Literatur findet man Ausdrücke wie „Low-dose extrapolation factor“, „Linear risk overestimation factor“, „Linear extrapolation overestimation factor“ usw. Um die Einflüsse von Dosisabhängigkeiten und von Dosisleistungs-Abhängigkeiten getrennt voneinander zu beschreiben, wird häufig der „Low-Dose Effectiveness Factor“ (LDEF) vom „Dose-Rate Effectiveness Factor“ (DREF) unterschieden. Für den LDEF wird für einzelne (akute) Expositionen bei verschiedenen Dosen die Krümmung bzw. die Kurvenform der Dosis-Wirkungsbeziehung analysiert. Eine derartige Analyse kann anhand einer einzelnen Dosis-Wirkungsbeziehung durchgeführt werden. Für den DREF werden die Steigungen bzw. die Kurvenformen bei verschiedenen Expositionen mit großer und mit kleiner Dosisleistung verglichen. Für einen derartigen Vergleich müssen also Ergebnisse von mindestens zwei Populationen (eine mit großer und eine mit kleiner Dosisleistung exponiert) herangezogen werden.
2.3 Zusammenhang mit LET und Energie
Modelle zur Extrapolation in den Bereich niedriger Dosen gehen zum großen Teil auf Überlegungen zurück, die sich auf das linear-quadratische Modell stützen (Abbildung 2). Viele zellbiologische und tierexperimentelle Studien lassen sich mit einem linear-quadratischen Dosis-Wirkungsmodell gut beschreiben. Auf der Grundlage mikrodosimetrischer Ansätze wurde dieses Modell ursprünglich auch auf mechanistische Wirkungszusammenhänge zurückgeführt („Theory of dual radiation action“) (Kellerer und Rossi 1972). Insbesondere ist dieses Modell in der Lage, LET-Abhängigkeiten verschiedener Strahlenarten zu deuten. Danach folgt eine beobachtete Wirkung W(D) nach Strahlenexposition folgender Beziehung:
| W(D) = α ⋅ D + β ⋅ D2 | (2.1) |
Dabei ist das α/β-Verhältnis eine eng mit dem LET korrelierte strahlenartspezifische Größe und entspricht dem Dosiswert, bei dem der lineare und der quadratische Term gleich groß sind. Für große α/β-Werte (großer LET-Wert, dicht ionisierende Strahlung) überwiegt der lineare Term im gesamten Dosisbereich, während für kleine α/β-Werte (kleiner LET-Wert, locker ionisierende Strahlung) der quadratische Anteil mit steigender Dosis zunehmend dominiert. Für niedrige Dosen geht das linear-quadratische Modell stets in das LNT-Modell über (vgl. Abbildung 2.2).
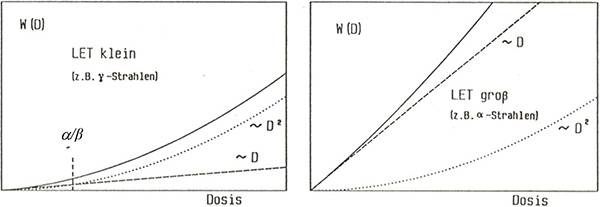
Abbildung 2.2: Linear-quadratische Dosis-Wirkungsbeziehungen für Strahlenarten mit kleinem und mit großem LET. Der Quotient alpha/beta hängt vom LET ab und bezeichnet den Dosiswert, für den der lineare und der quadratische Term gleich groß sind. Beachte: Der quadratische Anteil (gepunktete Linie) ist in beiden Abbildungsteilen gleich. Dosis-Wirkungsbeziehung berechnet nach
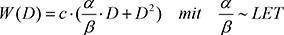 |
Die Bestimmung von Risikokoeffizienten in epidemiologischen Studien erfolgt in der Regel im Dosisbereich von 100 mSv bis zu einigen Sv. Wird aus diesem Dosisbereich unter Anwendung des LNT-Modells in den Bereich niedriger Dosen extrapoliert und folgt das tatsächliche Risiko einem linear-quadratischen Zusammenhang, so führt dies zu einer Überschätzung des Risikos, die vom α/β-Verhältnis (proportional zu LET) und von der Dosis abhängt (siehe Kapitel 2.2). Ein DDREF bzw. ein LDEF (siehe Gl (2.2)), der diese Überschätzung kompensieren soll, ist demzufolge ebenfalls sowohl vom α/β-Verhältnis (bzw. vom LET) als auch von der Dosis abhängig (Trabalka und Kocher 2007):
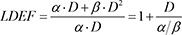 |
(2.2) |
In Abbildung 2.3 ist die Abhängigkeit des LDEF vom α/β-Verhältnis wiedergegeben. Wird beispielsweise aus einem Dosisbereich von 1 Sv linear in den Bereich niedriger Dosen extrapoliert, so führt ein Wert von α/β = 1 Sv zu einen LDEF = 2 (in der Abbildung markiert). Wird von 600 mSv aus extrapoliert, gelangt man zu LDEF = 1,6. Wird mit α/β = 3 Sv von 600 mSv aus extrapoliert, so ergibt dies LDEF = 1,2.
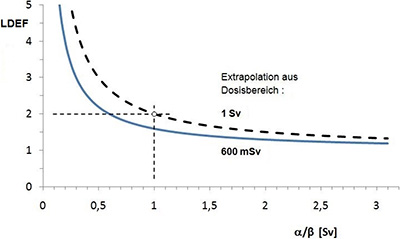
Abbildung 2.3: Abhängigkeit des LDEF vom α/β-Verhältnis einer linear-quadratischen Dosis-Wirkungsbeziehung (Gl. (2.2)) bei Extrapolation aus dem Dosisbereich von 1 Sv (gestrichelte Linie) und von 600 mSv (durchgezogene Linie).
Im Strahlenschutz wird die Strahlenqualität durch den LET-abhängigen Qualitätsfaktor zur Berechnung der Äquivalentdosis bzw. durch den Strahlungswichtungsfaktor zur Bestimmung der Organdosis berücksichtigt. Für Niedrig-LET-Strahlung ist der Qualitätsfaktor und der Strahlungswichtungsfaktor gleich 1. Somit stellt Niedrig-LET-Strahlung (Photonenstrahlung) die Referenzstrahlung zur Ermittlung von Risikokoeffizienten dar. Überlegungen zum DDREF sind also insbesondere für diese relevant. Da nach dem oben beschriebenen Modell für Strahlenarten mit größerem LET, d. h. mit größerem α/β-Verhältnis, der LDEF (bzw. der DDREF) kleiner ist, beschränkt sich die DDREF-Problematik lediglich auf Niedrig-LET-Strahlung.
2.4 Fazit
Wenn man davon ausgeht, dass bei hohen Dosen höhere Risiken pro Dosis als bei niedrigen Dosen bestehen, so führt eine lineare Extrapolation vom hohen in den niedrigen Dosisbereich zu einer Überschätzung des tatsächlichen Risikos („Dosis-Effekt“). Analoges gilt für die Extrapolation vom Bereich großer Dosisleistungen zu kleinen Dosisleistungen („Dosisleistungs-Effekt“). Für Zwecke des Strahlenschutzes wird diese mögliche Risikoüberschätzung durch einen gemeinsamen Faktor berücksichtigt, durch den die Risikokoeffizienten, die bei hohen Dosen und großen Dosisleistungen ermittelt wurden, dividiert werden. Vom Ansatz her ist der DDREF kein Faktor im eigentlichen Sinne eines inhärent konstanten Parameters bei der Abschätzung von Risikokoeffizienten. Vielmehr ist er u. a. abhängig von der jeweiligen Dosisleistung und von der jeweiligen Dosis, von welcher aus in den Bereich niedriger Dosen bzw. kleiner Dosisleistung extrapoliert wird. Darüber hinaus hängt er von der Strahlenqualität der betrachteten Strahlung ab und damit auch von der Energie der Strahlung (Trabalka und Kocher 2007). Die Art und Größe dieser Abhängigkeiten sind im Einzelnen jedoch nur unzureichend bekannt. Daher kommt dem DDREF – welcher Wert ihm auch zugeordnet sein mag – im Strahlenschutz eher eine allgemeine, nicht auf das Detail gerichtete Bedeutung zu. Unter Berücksichtigung all jener Abhängigkeiten werden die Effekte tatsächlich nur in einem konstanten „Faktor“, dem DDREF, zusammengefasst. Für die Belange des praktischen Strahlenschutzes kam die ICRP im Jahr 2007 zu dem Schluss, „that the adoption of the LNT model combined with a judged value of DDREF provides a prudent basis for practical purposes of radiological protection (i.e. the management of risks from low-dose radiation exposure in prospective situations)“ (ICRP 2007). Die ICRP hat im Jahr 2013 eine Task Group eingerichtet, um die Frage des DDREF neu zu diskutieren.
Die Strahlenschutzkommission hatte sich der Argumentation der ICRP bereits bei ihren Kommentaren zu ICRP 103 nicht angeschlossen und plädierte vielmehr für einen DDREF = 1, also für die Anwendung eines „reinen“ LNT-Modells (SSK 2006).
Literatur
| BEIR 2006 | Committee to Assess Health Risks from Exposure to Low Levels of Ionizing Radiation, Board on Radiation Effects, Research Division on Earth and Life Studies, National Research Council of the National Academies. Health risks from exposure to low levels of ionizing radiation. BEIR VII – Phase 2. United States National Academy of Sciences. National Academy Press, Washington DC. 2006 |
| Breckow 2006 | Breckow J. Linear-no-threshold is a radiation-protection standard rather than a mechanistic effect model. Radiat Environ Biophys. 2006;44:257-260 |
| Brenner und Sachs 2006 | Brenner DJ und Sachs RK. Estimating radiation-induced cancer risks at very low doses: rationale for using a linear no-threshold approach. Radiat Environ Biophys. 2006;44:253-256 |
| ICRP 2007 | International Commission on Radiological Protection (ICRP). The 2007 Recommendations of the International Commission on Radiological Protection. Publication 103, Annals of the ICRP 37 (2-4). Pergamon Press, Oxford. 2007 |
| Jacob et al. 2009 | Jacob P, Rühm W, Walsh L, Blettner M, Hammer G, Zeeb H. Cancer risk of radiation workers larger than expected? Occup. Environ. Med. published online 2009 Jun 30; doi:10.1136/oem.2008.043265 |
| Kellerer und Rossi 1972 | Kellerer AM und Rossi HH. The theory of dual radiation action. Curr Top Radiat Res. 1972;Q8:85-158 |
| Preston et al. 2003 | Preston DL, Shimizu Y, Pierce DA, Suyama A, Mabuchi K. Studies of mortality of atomic bomb survivors. Report 13: Solid cancer and noncancer disease mortality: 1950-1997. Radiat Res. 2003;160:381-407 |
| Preston et al. 2004 | Preston DL, Pierce DA, Shimizu Y, Cullings HM, Fujita S, Funamoto S, Kodama K. Effect of recent changes in atomic bomb survivor dosimetry on cancer mortality risk estimates. Radiat Res. 2004;162:377-389 |
| Preston et al. 2007 | Preston DL, Ron E, Tokuoka S, Funamoto S, Nishi N, Soda M, Mabuchi K. Solid cancer incidence in atomic bomb survivors: 1958-1998. Radiat Res. 2007;168:1-64 |
| Shore 2009 | Shore RE. Low-dose radiation epidemiology studies: Status and issues. Health Phys. 2009;97(5):481-486 |
| SSK 2006 | Strahlenschutzkommission (SSK). Comments on the 2006 Draft of the ICRP Recommendations. Stellungnahme der Strahlenschutzkommission. Verabschiedet in der 209. Sitzung der Strahlenschutzkommission am 5. September 2006 |
| Trabalka und Kocher 2007 | Trabalka JR und Kocher DC. Energy dependence of dose and dose-rate effectiveness factor for low-LET radiations: Potential importance to estimate of cancer risks and relationship to biological effectiveness. Health Phys. 2007;93(1):17-27 |
| Tubiana et al. 2006 | Tubiana M, Aurengo A, Averbeck D, Masse R. Recent reports on the effect of low doses of ionizing radiation and its dose-effect relationship. Radiat Environ Biophys. 2006;44:245-251 |
3 Strahlenbiologische Studien
3.1 In-vitro-Studien
3.1.1 Dosisabhängigkeiten
In-vitro-Studien wurden und werden häufig zur Begründung eines DDREF > 1 herangezogen, wobei vor allem der Bestimmung von Chromosomen-Aberrationen eine besondere Bedeutung beigemessen wurde. Es ist jedoch unklar, welche Rolle sie bei der Tumorinduktion spielen. Die starke Beachtung chromosomaler Veränderungen ist darauf zurückzuführen, dass man glaubte, mit der „Theory of dual radiation action“ (Kellerer und Rossi 1972) eine quantitativ belastbare Erklärung ihrer Entstehung gefunden zu haben, die es erlauben sollte, Dosis-Wirkungskurven auch in niedrige Dosisbereiche zu extrapolieren, in denen experimentelle Ergebnisse nicht vorlagen. Heute geht man allgemein davon aus, dass über einen großen Dosisbereich betrachtet im Bereich niedriger Dosen (einige 100 mGy) andere biologische Mechanismen wirken können als im Bereich hoher Dosen. Es ist allerdings nicht bekannt, welche Rolle diese Mechanismen bei niedrigen Dosen letztendlich für die Entstehung von gesundheitlichen Effekten spielen.
Neben den Chromosomenaberrationen sind andere untersuchte Effekte beispielsweise die Auslösung von Mutationen, der Verlust der Koloniebildungsfähigkeit sowie die In-vitro-Transformation. Neuerdings sind auch epigenetische Ansätze in das Zentrum des Interesses gerückt. Der Weg von der initialen Energiedeposition bis zur Manifestation eines Tumors ist lang und äußerst komplex (z. B. die Rolle des Immunsystems), was die Übertragbarkeit von In-vitro-Resultaten auf die Situation im menschlichen Körper sehr in Frage stellt. Hinzu kommt, dass bei zellulären Endpunkten nur selten zuverlässige Resultate bei niedrigen Dosen zu erreichen sind.
Die quantenhafte Struktur der Energieübertragung bei der Wechselwirkung ionisierender Strahlung mit Materie impliziert, dass es in einem Einzelereignis grundsätzlich keine beliebig kleine Energiedeposition geben kann. Die geringste deponierte Energiemenge bei einem Einzelereignis hängt von den Dimensionen des betrachteten Bereichs und dem LET der Strahlung ab. Bei Verringerung der Dosis reduziert sich nur die Zahl der zufällig verteilten Ereignisse in einem betrachteten Volumen, der im Mittel pro Ereignis deponierte Energiebetrag bleibt jedoch gleich. Falls die betrachteten Effekte linear von der Dosis abhängen, folgt aus dieser Überlegung, dass es für sie keine Schwellenwerte geben kann, diese sind also grundsätzlich nur möglich, falls eine nicht-lineare Dosis-Wirkungsbeziehung vorliegt.
Nicht-Linearitäten können auf verschiedene Ursachen zurückgeführt werden: Der einfachste Fall ist eine direkte Wechselwirkung zwischen (dosisproportional induzierten) Primärläsionen, z. B. DNA-Doppelstrangbrüchen (DBS), wie z. B. in der „Zweitreffertheorie“ zur Erklärung der Entstehung von Chromosomenaberrationen postuliert. Eine andere Möglichkeit besteht darin, dass die Wahrscheinlichkeit von Fehlern bei der Reparatur primärer Schäden mit deren Anzahl in einer Zelle ansteigt. Für Endpunkte, die auf einer Prozessierung der Primärläsionen durch die Zelle beruhen, könnte ein Schwellenwert auftreten, falls die Aktivierung der zellulären Prozesse erst oberhalb einer bestimmten Schadensmenge einsetzt. Umgekehrt könnten Sättigungsmechanismen zu einem Abflachen der Dosis-Wirkungsbeziehung führen. Nicht-lineare Abhängigkeiten können auch dadurch verursacht sein, dass auch nicht direkt von der Strahleneinwirkung betroffene Zellen Antwortsreaktionen zeigen (Bystander-Effekt) oder wenn Effekte erst verzögert in Nachkommen bestrahlter Zellen auftreten.
Inwieweit solche Prozesse für die Tumorentstehung relevant sind, ist unbekannt. Insofern können In-vitro-Studien zwar wichtige Anhaltspunkte liefern, sind aber nicht geeignet, Dosis- und Dosisleistungs-Abhängigkeiten für die Tumorinduktion zu begründen.
DNA-Schäden
DNA-Doppelstrangbrüche (DSB) werden durch locker ionisierende Strahlen über einen Bereich von 5 Zehnerpotenzen (1 mGy bis 100 Gy) in linearer Abhängigkeit von der Dosis induziert (Rothkamm und Löbrich 2003, Löbrich und Kiefer 2006).15 In Abhängigkeit von den genetischen Eigenschaften des untersuchten Systems können DSB repariert werden, dieser Prozess ist allerdings nicht fehlerfrei und kann zur Entstehung von Chromosomenaberrationen oder Mutationen führen. Die Wahrscheinlichkeit der Reparatur ist dosisabhängig. Bei Exposition < 10 mGy bleiben DSB sowohl in vitro als auch in vivo über lange Zeit erhalten (Grudzenski et al. 2010). In diesem Fall konnte die DSB-Reparatur jedoch durch H2O2 in Konzentrationen angeregt werden, die zu gering sind, um selbst DSB zu induzieren. Dies Phänomen lässt sich durch die Annahme interpretieren, dass durch Sauerstoffradikale, Einzelstrangbrüche oder Basenveränderungen Reparaturprozesse angeregt werden können, was auch dadurch gestützt wird, dass eine Reihe reparaturrelevanter Gene, die bei sehr niedrigen Dosen inaktiv sind, durch die Behandlung mit H2O2 hochreguliert werden (Grudzenski et al. 2010). Auf Fragen der Genregulation wird weiter unten noch eingegangen. Es muss derzeit offenbleiben, ob aus den beschriebenen Resultaten generell auf eine erhöhte Empfindlichkeit bei sehr niedrigen Dosen geschlossen werden kann, zumal in anderen Zelltypen und exponentiell wachsenden Populationen auch bei sehr niedrigen Dosen (um 1 mGy) eine vollständige DSB-Reparatur gefunden wurde (Asaithamby und Chen (2009).
Die Bedeutung von Reparaturprozessen für die experimentelle Bestimmung von DSB sowie möglicherweise die Ausbildung zellulärer Strahlenschäden wird durch eine neuere Arbeit von Neumaier et al. (2012) belegt. Ähnlich wie andere Autoren benutzten sie durch spezielle cytologische Techniken nachweisbare an DSB bindende Proteine, verfolgten aber auch den zeitlichen Verlauf der Ausbildung dieser Bindungen. Sie fanden, dass die mit dieser Methode abgeschätzte Zahl von durch Röntgenstrahlen induzierten DSB („Foci“) über den untersuchten Dosisbereich (50 mGy bis 4 Gy) nicht gleichmäßig proportional mit der Dosis anstieg. Bei niedrigen Dosen wurden signifikant mehr Foci pro Dosiseinheit gemessen als bei höheren. Dies wird durch die Annahme interpretiert, dass benachbarte DSB sich zu „Reparaturzentren“ aggregieren, die im mikroskopischen Bild als Foci erscheinen, somit also einen einzelnen DSB vortäuschen. Falls man, wie die Autoren annehmen, postuliert, dass diese aggregierten DSB vor allem den Ausgangspunkt für fehlerhafte Reparaturprozesse und somit auch Mutationen und Transformationen sein könnten, ergäbe sich daraus ein überproportionaler Anstieg für solche Endpunkte bei höheren Dosen, wodurch eine nicht-lineare Dosisabhängigkeit plausibel gemacht werden könnte. Allerdings muss bemerkt werden, dass die beschriebenen Annahmen auch schon vorher gemacht wurden (z. B. zur Erklärung der Entstehung von Chromosomenaberrationen) und somit durch die neuen experimentellen Ergebnisse, so wichtig sie für die Quantifizierung primärer Strahlenschäden sind, für das Verständnis der Tumorinduktion keine neuen Argumente geliefert werden.
Chromosomenaberrationen
Für Chromosomenaberrationen findet man bei Röntgen- und Gamma-Strahlen in der Regel eine linear-quadratische Abhängigkeit, dies gilt sowohl für dizentrische (instabile) Aberrationen als auch für (stabile) Translokationen (UNSCEAR 2000, Sasaki 2009). Die Empfindlichkeit dieser Methodik ist begrenzt. In Säugerzellen können statistisch signifikante Resultate bei erheblichem experimentellem Aufwand nur bei Dosen deutlich über 20 mGy nachgewiesen werden (UNSCEAR 2000, dort auch weitere Literaturangaben).
In einer Reihe von Studien wurden strahleninduzierte einfache und komplexe Chromosomen-Austauschaberrationen (Beteiligung von mehr als zwei Bruchpunkten) hinsichtlich ihrer Dosis- und Dosisleistungs-Abhängigkeit untersucht (Loucas et al. 2004, Cornforth 2006). Bei großen Dosisleistungen erhält man für die Gesamtheit aller Aberrationen eine linear-quadratische Dosisabhängigkeit, wobei allerdings, wie eine nähere Analyse zeigt, die Nicht-Linearität ausschließlich auf komplexe Aberrationen zurückgeht. Im Falle sehr kleiner Dosisleistungen erhält man eine klar lineare Dosisabhängigkeit (siehe unten Abbildung 3.1). Es zeigt sich ein nur schwacher Dosis-Effekt (schwache Abweichung von einer Linearität), jedoch ein starker Dosisleistungs-Effekt (ca. Faktor 5 bei Steigung im linearen Teil). Daraus könnte man folgern, dass in diesem Falle komplexe Aberrationen nicht gebildet werden, was jedoch nicht der Fall ist. Zwar ist ihr Anteil deutlich geringer, jedoch bleibt er signifikant.
Zellüberleben, Mutationen, In-vitro-Transformation
Die Überlebenskurven für Säugerzellen nach Exposition mit locker ionisierenden Strahlen zeigen im Allgemeinen eine nicht-lineare Dosisabhängigkeit, die häufig durch eine linear-quadratische Funktion beschrieben wird, wobei die niedrigsten experimentell erfassbaren Dosen jedoch um 0,5 Gy liegen. Mit Hilfe besonderer Techniken ist es heute möglich, auch niedrigere Bereiche zu erfassen. Dabei zeigten sich überraschende Befunde: Im Bereich von ca. 300 mGy bis 600 mGy ergaben sich deutliche Abweichungen von den „Standardüberlebenskurven“, die Zellen waren erheblich empfindlicher als erwartet. Dieses Phänomen, das allerdings nicht in allen Zelltypen gefunden wird, wird als „low dose radiation hypersensitivity (HRS)“ bezeichnet. Das Überleben bei niedrigen Dosen kann also nicht aus der Rückextrapolation von hohen Dosen ermittelt werden. Das beschriebene Verhalten kann durch die Annahme erklärt werden, dass erst bei höheren Dosen Reparaturprozesse induziert werden, die bei niedrigeren inaktiv bleiben (Marples und Joiner 1993). Der Übergang wird offenbar durch eine Aktivierung des ATM-Gens („Ataxia teleangiectasia mutated“) bewirkt, das eine wichtige Rolle bei der Auslösung von strahleninduzierten Verzögerungen des Zellzyklus spielt. Es ist schon lange bekannt, dass nach Exposition der Fortgang der G2-Phase im Zellzyklus verlangsamt und dadurch Zeit für eine Schadensreparatur gewonnen wird. Dieser „klassische G2-checkpoint“ liegt relativ spät in der G2-Phase. Seit kurzem ist jedoch auch ein „früher“ G2-Kontrollpunkt bekannt, für dessen Funktion offenbar das ATM-Gen eine entscheidende Rolle spielt (Xu et al. 2002) und der durch eine klare Dosisschwelle von weniger als 400 mGy charakterisiert wird (Krueger et al. 2007a), bei niedrigeren Dosen wird der Zellzyklusablauf nicht angehalten Die Dauer der Verzögerung am „frühen“ G2-Verzögerungspunkt ist dosisunabhängig, im Gegensatz zu dem „klassischen“ G2-Block, dessen Länge mit der Dosis ansteigt. Die hohe Empfindlichkeit bei sehr niedrigen Dosen resultiert daraus, dass die frühe Zellzykluskontrolle, deren Schwelle bei ca. 10 DSB bis 20 DSB liegt (Löbrich und Jeggo 2007), nicht aktiviert wird und somit keine Zeit für die Reparatur der DSB zur Verfügung steht. Die Zellen mit unreparierten DSB scheiden dann wahrscheinlich durch Apoptose aus (Krueger et al. 2007b). Das Phänomen der HRS ist bisher nur in Bezug auf das Überlebensverhalten nachgewiesen (Übersicht bei Marples und Collis 2008), es lässt sich als ein Schutzmechanismus gegen die Proliferation von Zellen mit vererbbaren Schäden deuten und kann somit nicht als Beleg für eine erhöhte Empfindlichkeit in Bezug auf stochastische Wirkungen herangezogen werden. Um diese zu begründen, wären auf zellulärer Ebene entsprechende Studien zur Mutationsauslösung oder zur In-vitro-Transformation notwendig, die nicht vorliegen.
Die Mutationsauslösung in Säugerzellen durch Niedrig-LET-Strahlung zeigt in den meisten Fällen eine linear-quadratische Abhängigkeit von der Dosis. Die verfügbaren Methoden erlauben allerdings keine Untersuchungen bei sehr niedrigen Dosen, die unterste Grenze liegt bei ca. 250 mGy in menschlichen Lymphoblastoid-Zellen (TK6), die sehr empfindlich reagieren (König und Kiefer 1988). Eine Erhöhung der Sensibilität bei niedrigen Dosen konnte bisher nicht gefunden werden.
Von allen zellulären Parametern hat die In-vitro-Transformation die engste Beziehung zur Risikoabschätzung für stochastische Effekte. Sie kann in speziellen Zellsystemen untersucht werden. Repräsentative Daten wurden in einer europäischen Gemeinschaftsstudie ermittelt, an der sechs Laboratorien teilnahmen (Mill et al. 1998). In den am häufigsten verwendeten C3H10T1/2-Zellen erhält man von 250 mGy bis 5 Gy eine lineare Dosis-Wirkungsabhängigkeit, wenn eine Korrektur für den Anteil abgetöteter Zellen durchgeführt wird. Über das Verhalten bei geringeren Dosen liegen keine Untersuchungen vor.
Bystander-Effekt, verzögerte Wirkungen, genomische Instabilität16, Adaptive Response
Strahlenwirkungen können sich auch in Zellen zeigen, die nicht direkt getroffen wurden. Dieses Phänomen, das üblicherweise als Bystander-Effekt bezeichnet wird, kann entweder durch gezielte Expositionen einzelner Zellen mit Hilfe von Mikrostrahlanlagen oder aber auch durch den Einfluss von Kulturmedien bestrahlter Populationen auf unbestrahlte Zellen demonstriert werden. Es widerspricht der klassischen Vorstellung, dass nur direkte Energiedepositionen strahlenbiologische Wirkungen hervorrufen. Der zugrunde liegende Mechanismus ist nach wie vor umstritten, sicher scheint jedoch zu sein, dass bestrahlte Zellen chemische Signale abgeben, die in den Empfängern strahlentypische Effekte auslösen. Dazu gehören Verlust der Teilungsfähigkeit, Chromosomenaberrationen (Lorimore et al. 1998), Schwester-Chromatid-Austausche (Lehnert et al. 1997), Mikrokerne (Belyakov et al. 2001), Mutationen (Nagasawa und Little 1999) sowie neoplastische Transformationen (Sawant et al. 2001). Der Bystander-Effekt spielt naturgemäß vor allem bei niedrigen Dosen eine Rolle, bei denen ein nennenswerter Anteil der Zellpopulation nicht direkt getroffen wird. Er führt zu einer (virtuellen) Vergrößerung des Treffbereichs und somit zu einer größeren Strahlenwirkung als auf Grund konventioneller Dosimetrie zu erwarten wäre.
In Zellen, die eine Bestrahlung überlebt haben, zeigen sich häufig verzögerte Wirkungen: das Koloniebildungsvermögen ist auch nach mehreren Generationen deutlich (abhängig von der ursprünglichen Dosis) vermindert, und es kommt auch zu verzögertem Auftreten von Mutationen. Ihr Spektrum unterscheidet sich von dem der direkt induzierten, was darauf hindeutet, dass durch die Strahleneinwirkung eine gewisse Labilisierung des Genoms bewirkt wird, die üblicherweise als „genomische Instabilität“ bezeichnet wird (Smith et al. 2003, Streffer 2010). Dieses Phänomen wurde zuerst in bestrahlten Zweizellzygoten von Mausembryonen gefunden (Pampfer und Streffer 1989), später auch in menschlichen Knochenmarkszellen (Kadhim et al. 1995). Nach heutiger Einschätzung könnte sie eine entscheidende Rolle bei der Karzinogenese spielen, allerdings gibt es Hinweise, dass sie in vitro nur in transformierten Zellen auftritt (Dugan und Bedford 2003), was diese interessante Hypothese in Frage stellen würde. Die bisher beschriebenen Phänomene können tendenziell zu einer höheren Empfindlichkeit bei niedrigen Dosen führen, als man durch eine Extrapolation von größeren Dosen erwarten würde.
Ein anderer Effekt, der als Adaptive Response bezeichnet wird, äußert sich in einer protektiven Wirkung niedriger Dosen. Durch eine Vorbestrahlung mit einer Dosis im Bereich von 10 mGy bis 200 mGy („priming dose“) kann das Schadensniveau bei einer folgenden Exposition mit deutlich höheren Dosen („challenging dose“) signifikant verringert werden. Dies wurde zunächst für Chrosomenaberrationen gefunden (Olivieri et al. 1984), später aber auch für andere Endpunkte demonstriert, nämlich Mutationen und Koloniebildungsfähigkeit (Zhou et al. 2003, Cai und Liu 1990) sowie neoplastische Transformationen (Elmore et al. 2008). Der Adaptive Response zeichnet sich durch eine große Variabilität aus und wird durchaus nicht in allen Systemen gefunden (Preston 2005, Schwartz 2007, Tapio und Jacob 2007).
Beeinflussung der Genaktivität und epigenetische Effekte
Zellen reagieren auf eine Strahlenexposition durch eine Veränderung der Aktivität einer großen Zahl von Genen (Criswell et al. 2003, Ljungman 2010), u. a. auch derjenigen, die an Reparaturprozessen und der Zellzyklusregulation beteiligt sind. Das Muster der Sätze von betroffenen Genen und das Ausmaß der induzierten Veränderungen unterscheiden sich allerdings bei hohen und niedrigen Dosen (Amundson et al. 2003, Ding et al. 2005). Auf der Basis dieser Befunde wurden Modelle entwickelt, welche die Phänomene des Bystander-Effekts und des Adaptive Response auf molekularer Grundlage erklären sollen (siehe z. B. Matsumoto et al. 2009), allerdings harren sie noch der Bestätigung. Neben diesen sogenannten „non-targeted effects“ oder „delayed effects“ sind in den letzten Jahren zunehmend stärker auch sogenannte „epigenetische Effekte“ für das Verständnis von regulatorischen Zellprozessen wichtig geworden. Epigenetische Effekte nehmen auf die Regulierung der Genexpression Einfluss, ohne dass die Information hierfür auf der DNA gespeichert sein muss. Welche Rollen „non-targeted effects“, „delayed effects“ oder epigenetische Einflüsse auf strahleninduzierte molekulare und zelluläre Effekte und deren Reparatur haben, ist jedoch weitgehend ungeklärt (Little 2010). Dies trifft insbesondere auf deren mögliche modifizierende Einflüsse auf Dosis- und Dosisleistungs-Abhängigkeiten zu.
3.1.2 Dosisleistungsabhängigkeiten
Bei kleinen Dosisleistungen findet man eine deutlich verringerte Ausbeute an Chromosomen-Aberrationen (siehe Abbildung 3.1). Die Dosis-Wirkungskurve ist rein linear mit einer im Vergleich zu akuter Exposition um einen Faktor 5 geringeren Steigung. Ein ähnliches Verhalten ist in den meisten Fällen auch in Bezug auf das Zellüberleben zu finden. Ein Absenken der Dosisleistung führt bei dem Verlust der Koloniebildungsfähigkeit in der Regel zu einem verringerten Effekt (Amdur und Bedford 1994), bei einigen Zelllinien zeigt sich jedoch auch ein „inverser Dosisleistungs-Effekt“, d. h. eine erhöhte Strahlenempfindlichkeit, wenn die Dosisleistung unter 300 mGy/h liegt (Mitchell et al. 2002), was mit der „low dose hypersensitivity“ (siehe unten) in Verbindung gebracht wird. Ein solches Verhalten hängt offenbar von genetischen Faktoren ab und wird nicht durchgängig gefunden (Williams et al. 2008). In einer neueren Arbeit wurde die Wirkung unterschiedlicher Dosisleistungen auf die Bildung von Mikrokernen untersucht, wobei gefunden wurde, dass die Ausbeute von Mikrokernen bei sinkender Dosisleistung zunimmt (Brehwens et al. 2010).
Bei In-vitro-Transformationen wurde eine protektive Wirkung einer Bestrahlung mit kleinen Dosisleistungen gefunden (Elmore et al. 2006, Elmore et al. 2008), welche auf einen Adaptive-Response-Effekt zurückgeführt wurde (Ko et al. 2006). Die Autoren folgern daraus, dass unter diesen Bedingungen von einem verringerten Krebsrisiko auszugehen ist.
Ein deutlicher „inverser Dosisleistungs-Effekt“ („inverse dose rate effect“) wurde von verschiedenen Arbeitsgruppen und in unterschiedlichen Zelllinien für die Mutationsauslösung gefunden, die Mutantenausbeute pro Dosis steigt bei sinkender Dosisleistung an (Vilenchik und Knudson 2000), ein überraschendes Ergebnis, das für Gamma-Strahlen bereits seit dem Jahr 1990 festgestellt (Crompton et al. 1990), jedoch nur wenig beachtet wurde. Eine nähere Analyse zeigt, dass dieses Phänomen nur in exponentiell wachsenden, nicht aber in stationären Zellpopulationen auftritt (Brehwens et al. 2010, Kiefer et al. 2002).
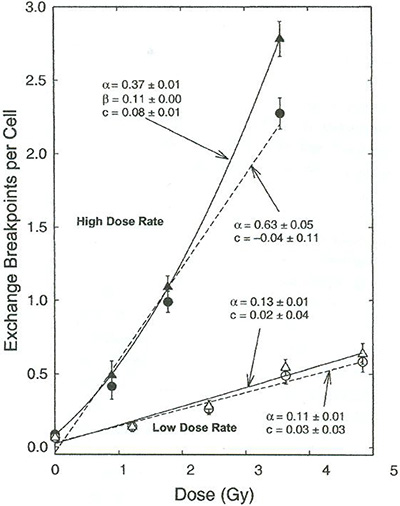
Abbildung 3.1: Anzahl der Bruchstellen pro Zelle bei Chromosomen-Austauschaberrationen in Abhängigkeit
von der Dosis bei verschiedenen Dosisleistungen. Die Parameter α und β geben den linearen
bzw. quadratischen Term in der linear-quadratischen Beziehung (siehe Gl. 2.1) an,
c ist der Achsenabschnitt der Polynome. Dreiecke geben „komplexe“ Aberrationen (mehrere
Bruchstellen pro Austausch), Kreise „einfache“ Aberrationen (eine oder wenige Bruchstellen
pro Austausch) an.
3.1.3 Fazit
Auf molekularer und zellulärer Ebene (In-vitro-Studien) lässt sich bei verschiedenen Zellsystemen und in Abhängigkeit von den untersuchten Endpunkten eine Vielzahl von linearen und nicht-linearen Effekten beobachten. Über einen großen Dosisbereich betrachtet geht man heute davon aus, dass im Bereich niedriger Dosen (< 100 mGy) andere biologische Mechanismen wirken können als im hohen Dosisbereich. Es ist allerdings nicht bekannt, welche Rolle diese Mechanismen bei niedrigen Dosen letztendlich für die Entstehung von gesundheitlichen Effekten spielen.
Hinsichtlich der Bedeutung zur Beurteilung eines DDREF ergibt sich hieraus kein klares Bild. Während die Anzahl der Doppelstrangbrüche und anderer strahleninduzierter DNA-Schäden linear mit der Dosis ansteigen, weisen Chromosomenaberrationen und Reparaturvorgänge zumindest teilweise nicht-lineare Dosis-Wirkungskomponenten auf. Abhängigkeiten von der Dosisleistung können in einer Reihe von Effekten beobachtet werden, wobei allerdings nicht in jedem Fall eine Reduzierung der Effektivität bei kleiner Dosisleistung gefunden wird. Es gibt allerdings keine eindeutigen Hinweise für einen klaren Zusammenhang von Dosis- und Dosisleistungs-Effekten, vielmehr scheinen sie weitgehend „entkoppelt“ zu sein.
Da die Möglichkeiten der Epidemiologie bei niedrigen Dosen und kleinen Dosisleistungen limitiert sind, wurde häufig die Ansicht vertreten, dass eine Antwort auf die offenen Fragen durch die Aufklärung grundlegender Mechanismen mit Hilfe von In-vitro-Studien erwartet werden kann. Nach derzeitigem Forschungsstand ist die Lage bei In-vitro-Studien jedoch ambivalent, sodass sie kaum zur Begründung des DDREF herangezogen werden können. Während über lange Zeit davon ausgegangen wurde, dass Dosis-Wirkungskurven für Chromosomenaberrationen, Mutationsinduktion und den Verlust der Koloniebildungsfähigkeit nach Einwirken locker ionisierender Strahlen generell durch eine linear-quadratische Funktion beschrieben werden, ist diese Vorstellung, die letztlich auf mikrodosimetrischen Überlegungen beruhte und eine theoretische Begründung für Nicht-Linearitäten und damit auch für Dosisleistungs-Effekte liefert, durch neue Untersuchungen und die Demonstration „unkonventioneller“ Effekte (Bystander-Effekt, „low dose hypersensitivity“, genomische Instabilität) in Frage gestellt worden.
Selbst wenn generell von nicht-linearen Effekten auf der In-vitro-Ebene ausgegangen werden kann, ist weitgehend unklar, ob und wie sie in komplexen biologischen Prozessen zusammenwirken und ob und in welcher Weise für die Krebsentstehung Nicht-Linearitäten in vivo „weitergegeben“ werden.
Literatur
| Amdur und Bedford 1994 | Amdur RJ und Bedford JS. Dose-rate effects between 0.3 and 30 Gy/h in a normal and a malignant human cell line. Int J Radiat Oncol Biol Phys. 1994;30(1):83-90 |
| Amundson et al. 2003 | Amundson SA, Lee RA, Koch-Paiz CA, Bittner ML, Meltzer P, Trent JM, Fornace J. Differential responses of stress genes to low dose-rate γ irradiation. Mol. Cancer Res. 2003;1:445-452 |
| Asaithamby und Chen 2009 | Asaithamby A und Chen DJ. Cellular responses to DNA double-strand breaks after low-dose gamma-irradiation. Nucleic Acids Res. 2009;37(12):3912-3923 |
| Belyakov et al. 2001 | Belyakov OV, Malcolmson AM, Folkard M, Prise KM, Michael BD. Direct evidence for a bystander effect of ionizing radiation in primary human fibroblasts. Br J Cancer. 2001;84(5):674-679 |
| Brehwens et al. 2010 | Brehwens K, Staaf E, Haghdoost S, González AJ, Wojcik A. Cytogenetic damage in cells exposed to ionizing radiation under conditions of a changing dose rate. Radiat Res. 2010;173(3):283-289 |
| Cai und Liu 1990 | Cai L und Liu SZ. Induction of cytogenetic adaptive responses of somatic and germ cells in vivo and in vitro by low dose X-irradiation. Int. J. Radiat. Biol. 1990;58:187–194 |
| Cornforth 2006 | Cornforth MN. Perspectives on the formation of radiation-induced exchange aberrations. 2006 Sep 8;5(9-10):1182-1191. Epub 2006 Jun 27 |
| Criswell et al. 2003 | Criswell T, Leskov K, Miyamoto S, Luo G, Boothman DA. Transcription factors activated in mammalian cells after clinically relevant doses of ionizing radiation. Oncogene. 2003;22(37):5813-5827 |
| Crompton et al. 1990 | Crompton NE, Barth B, Kiefer J. Inverse dose-rate effect for the induction of 6-thioguanine-resistant mutants in Chinese hamster V79-S cells by 60Co gamma rays. Radiat Res. 1990;124(3):300-308 |
| Ding et al. 2005 | Ding L-H, Shingyoji M, Chen F, Hwang J-J, Burma S, Lee C, Cheng J-F, Chen DJ. Gene expression profiles of normal human fibroblasts after exposure to ionizing radiation: a comparative study of low and high doses. Radiat Res. 2005;164:17-26 |
| Dugan und Bedford 2003 | Dugan LC und Bedford J.S. Are chromosomal instabilities induced by exposure of cultured normal human cells to low- or high-LET radiation? Radiat Res. 2003;159:301-311 |
| Elmore et al. 2006 | Elmore E, Lao XY, Kapadia R, Redpath JL. The effect of dose rate on radiation-induced neoplastic transformation in vitro by low doses of low-LET radiation. Radiat Res. 2006;166(6):832-838 |
| Elmore et al. 2008 | Elmore E, Lao XY, Kapadia R, Giedzinski E, Limoli C, Redpath JL. Low doses of very low-dose-rate low-LET radiation suppress radiation-induced neoplastic transformation in vitro and induce an adaptive response. Radiat Res. 2008;169(3):311-318 |
| Grudzenski et al. 2010 | Grudzenski S, Raths A, Conrad S, Rübe CE, Löbrich M. Inducible response required for repair of low-dose radiation damage in human fibroblasts. Proc Natl Acad Sci U S A. 2010;107(32):14205-14210 |
| Kellerer und Rossi 1972 | Kellerer AM und Rossi HH. The theory of dual radiation action. Current topics radiation research quarterly. 1972;8:85-158 |
| Kadhim et al. 1995 | Kadhim MA, Lorimore SA, Townsend KM, Goodhead DT, Buckle VJ, Wright EG. Radiation-induced genomic instability: delayed cytogenetic aberrations and apoptosis in primary human bone marrow cells. Int J Radiat Biol. 1995;67:287-93 |
| Kiefer et al. 2002 | Kiefer J, Kohlpoth M, Kuntze M. Mutation induction by continuous low dose rate gamma irradiation in human cells. International Congress Series, Radiation and homeostasis. 2002 Jul;Vol 1236:255-263 |
| Ko et al. 2006 | Ko M, Lao XY, Kapadia R, Elmore E, Redpath JL. Neoplastic transformation in vitro by low doses of ionizing radiation: role of adaptive response and bystander effects. Mutat Res. 2006;597(1-2):11-17 |
| König und Kiefer 1988 | König F und Kiefer J. Lack of dose-rate effect for mutation induction by gamma-rays in human TK6 cells. Int J Radiat Biol. 1988;54(6):891-7 |
| Krueger et al. 2007a | Krueger SA, Collis SJ, Joiner MC, Wilson GD, Marples B. The transition in survival from low-dose hyper-radiosensitivity to increased radioresistance is independent of activation of ATM SER1981 activity. Int J Radiat Oncol Biol Phys. 2007;69:1262–1271 |
| Krueger et al. 2007b | Krueger SA, Joiner MC, Weinfeld M, Piasentin E, Marples B. Role of apoptosis in low-dose hyper-radiosensitivity. Radiat Res. 2007;167(3):260-267 |
| Lehnert et al. 1997 | Lehnert BE, Goodwin EH, Deshpande A. Extracellular factor(s) following exposure to alpha particles can cause sister chromatid exchanges in normal human cells. Cancer Res. 1997;57(11):2164-2171; Erratum in: Cancer Res. 2003;63(6):1439 |
| Little 2010 | Little, MP. Do non-targeted effects increase or decrease low dose risk in relation to the linear-non-threshold (LNT) model? Mutat Res. 2010;687:17-27 |
| Ljungman 2010 | Ljungman M. The DNA damage response − repair or despair? Environ Mol Mutagen. 2010;51(8-9):879-889 |
| Löbrich und Kiefer 2006 | Löbrich M und Kiefer J. Assessing the likelihood of severe side effects in radiotherapy. Int J Cancer. 2006;118(11):2652-2656 |
| Löbrich und Jeggo 2007 | Löbrich M und Jeggo PA. The impact of a negligent G2/M checkpoint on genomic instability and cancer induction. Nat Rev Cancer. 2007;7(11):861-869 |
| Lorimore et al. 1998 | Lorimore SA, Kadhim MA, Pocock DA, Papworth D, Stevens DL, Goodhead DT, Wright EG. Chromosomal instability in the descendants of unirradiated surviving cells after alpha-particle irradiation. Proc Natl Acad Sci U S A. 1998;95(10):5730-5733 |
| Loucas et al. 2004 | Loucas BD, Eberle R, Bailey SM, Cornforth MN. Influence of dose rate on the induction of simple and complex chromosome exchanges by gamma rays. Radiat Res. 2004;162:339-349 |
| Marples und Collis 2008 | Marples B und Collis SJ. Low-dose hyper-radiosensitivity: past, present, and future. Int J Radiat Oncol Biol Phys. 2008;70(5):1310-1318 |
| Marples und Joiner 1993 | Marples B und Joiner MC. The response of Chinese hamster V79 cells to low radiation doses: Evidence of enhanced sensitivity of the whole cell population. Radiat Res. 1993;133:41-51 |
| Matsumoto et al. 2009 | Matsumoto H, Tomita M, Otsuka K, Hatashita M. A new paradigm in radioadaptive response developing from microbeam research. J Radiat Res. (Tokyo). 2009;50 Suppl A:A67-79 |
| Mill et al. 1998 | Mill AJ, Frankenberg D, Bettega D, Hieber L, Saran A, Allen LA, Calzolari P, Frankenberg-Schwager M, Lehane MM, Morgan GR, Pariset L, Pazzaglia S, Roberts CJ, Tallone L. Transformation of C3H 10T1/2 cells by low doses of ionising radiation: A collaborative study by six European laboratories strongly supporting a linear dose-response relationship. J Radiol Prot. 1998;18(2):79-100 |
| Mitchell et al. 2002 | Mitchell CR, Folkard M, Joiner MC. Effects of exposure to low-dose-rate 60Co gamma rays on human tumor cells in vitro. Radiat Res. 2002;158(3):311-318 |
| Nagasawa und Little 1999 | Nagasawa H und Little JB. Unexpected sensitivity to the induction of mutations by very low doses of alpha-particle radiation: evidence for a bystander effect. Radiat Res. 1999;152(5):552-557 |
| Neumaier et al. 2012 | Neumaier T, Swenson J, Pham C, Polyzos A, Lo AT, Yang P, Dyball J, Asaithamby A, Chen DJ, Bissell MJ, Thalhammer S, Costes SV. Evidence for formation of DNA repair centers and dose-response nonlinearity in human cells: Proc Natl Acad Sci U S A. 2012;109(2):443-8 |
| Olivieri et al. 1984 | Olivieri G, Bodycote J, Wolff S. Adaptive response of human lymphocytes to low concentrations of radioactive thymidine. Science. 1984;223:594-597 |
| Pampfer und Streffer 1989 | Pampfer S und Streffer C. Increased chromosome aberration levels in cells from mouse fetuses after zygote X-irradiation. Int J Radiat Biol. 1989;55:85-92 |
| Preston 2005 | Preston RJ. Bystander effects, genomic instability, adaptive response, and cancer risk assessment for radiation and chemical exposures. Toxicol Appl Pharmacol. 2005;207(2 Suppl):550-556 |
| Rothkamm und Löbrich 2003 | Rothkamm K und Löbrich M. Evidence for a lack of DNA double-strand break repair in human cells exposed to very low x-ray doses. Proc Natl Acad Sci U S A. 2003;100(9):5057-5062 |
| Sasaki 2009 | Sasaki MS. Advances in the biophysical and molecular bases of radiation cytogenetics. Int J Radiat Biol. 2009;85(1):26-47 |
| Sawant et al. 2001 | Sawant SG, Randers-Pehrson G, Geard CR, Brenner DJ, Hall EJ. The bystander effect in radiation oncogenesis: I. Transformation in C3H 10T1/2 cells in vitro can be initiated in the unirradiated neighbors of irradiated cells. Radiat Res. 2001;155(3):397-401 |
| Schwartz 2007 | Schwartz JL. Variability: the common factor linking low dose-induced genomic instability, adaptation and bystander effects. Mutat Res. 2007;616(1-2):196-200 |
| Smith et al. 2003 | Smith LE, Nagar S, Kim GJ, Morgan WF. Radiation-induced genomic instability: radiation quality and dose response. Health Phys. 2003;85(1):23-29 |
| Streffer 2010 | Streffer C. Strong association between cancer and genomic instability. Radiat Environ Biophys. 2010;49(2):125-131 |
| Tapio und Jacob 2007 | Tapio S und Jacob V. Radioadaptive response revisited. Radiat Environ Biophys. 2007;46(1):1-12, Epub 2006 Nov 28 |
| UNSCEAR 2000 | United Nations Scientific Committee on the Effects of Atomic Radiation (UNSCEAR). Report 2000: Sources and Effects of Ionizing Radiation, Biological effects of low radiation doses. 2000; Vol. II:177-296 |
| Vilenchik und Knudson 2000 | Vilenchik MM und Knudson AG Jr. Inverse radiation dose-rate effects on somatic and germ-line mutations and DNA damage rates. Proc Natl Acad Sci U S A. 2000;97(10):5381-5386 |
| Williams et al. 2008 | Williams JR, Zhang Y, Zhou H, Gridley DS, Koch CJ, Slater JM, Little JB. Overview of radiosensitivity of human tumor cells to low-dose-rate irradiation. Int J Radiat Oncol Biol Phys. 2008;72(3):909-917 |
| Xu et al. 2002 | Xu B, Kim ST, Lim DS, Kastan MB. Two molecularly distinct G(2)/M checkpoints are induced by ionizing irradiation. Mol Cell Biol. 2002;22:1049-1059 |
| Zhou et al. 2003 | Zhou H, Randers-Pehrson G, Geard CR, Brenner DJ., Hall EJ, Hei TK. Interaction between radiation-induced adaptive response and bystander mutagenesis in mammalian cells. Radiat Res. 2003;160:512-516 |
3.2 In-vivo-Studien
3.2.1 Tierstudien zum DDREF
Die Ergebnisse von Tierversuchen haben einen beträchtlichen Einfluss auf die Entscheidungen gehabt, einen DDREF einzuführen und auch in Zukunft zu benutzen. BEIR VII (2006) schloss z. B. „…animal data relating to protracted radiation exposures provide a convincing argument for the inclusion of DDREF in judgments about cancer risk at low doses and low dose rates. The animal data showing reduction in carcinogenic effectiveness, including life shortening, following protracted exposure constitute the strongest element in this argument…“.
Anfängliche Auswertungen von Tierversuchen in Bezug auf den DDREF kamen zu dem Schluss, dass die Form der Dosis-Wirkungsbeziehungen zwischen verschiedenen Spezies und Tumorarten sehr stark variiert. Nichtsdestotrotz wurde festgestellt, dass die Mehrzahl vorhandener „relevanter“ Daten eine linear-quadratische Beziehung unterstützt (BEIR VII). Eine detaillierte Darstellung der Studien findet sich in Anhang A.
Es ist gerade dieser Bezug auf die selektive Auswahl vorhandener „relevanter Daten“, welche die Hauptschwäche der Interpretation von Tierversuchen darstellt. Die Entscheidung, ob eine spezielle Studie relevant ist, macht einen willkürlichen Eindruck, wobei die Entscheidung auf nicht transparente Argumente gestützt wird. Zum Beispiel wurden Ovarialtumoren und Lymphome des Thymus von BEIR VII ausgeschlossen, aber Tumoren der Harderschen Drüse, für die es im Menschen kein Äquivalent gibt, wurden berücksichtigt (siehe BEIR VII Kapitel 3). Darüber hinaus muss die Übertragung von Daten aus Untersuchungen mit Mäusen auf die menschliche Situation mit Vorsicht vorgenommen werden, vor allem weil die unterschiedliche genetische Ausstattung verschiedener Inzucht-Mäusestämme einen großen Einfluss darauf hat, welche Tumorart besonders häufig vorkommt. Die Histologie üblicher strahleninduzierter Maustumoren, z. B. der Schilddrüse und der Brust, korrespondieren nicht mit den strahleninduzierten Tumoren bei Menschen, wie sie z. B. in der Life Span Study oder nach dem Tschernobyl-Unfall gefunden werden.
Aus Zweckmäßigkeitsgründen und um die Auswertungskriterien konstant zu halten, beschränkt sich diese detaillierte Übersicht im Wesentlichen auf Mausmodelle. Die Hauptschlussfolgerungen können nichtsdestoweniger auch auf Studien mit anderen Spezies übertragen werden (besonders Studien mit Ratten und Beaglehunden).
Die Bedeutung von Studien an Maus-Inzuchtlinien in der Strahlenbiologie ist nicht unumstritten. Inzuchtstämme wurden ursprünglich zur Beantwortung einer Vielzahl biologischer Fragestellungen gezüchtet, um einerseits die phänotypische Selektion von gewünschten Merkmalen und andererseits weniger gewünschte Merkmale auszuschließen. Die Strahlenempfindlichkeit dieser Stämme ist allgemein sehr viel höher als von anderen kürzer lebenden Wildtypmäusen. Außerdem zeigen die meisten Linien ein ungewöhnlich hohes sporadisches Aufkommen von einer oder mehreren Krebsarten.
3.2.2 Der Einfluss von „Non-Target-Processes“ auf die Form der Dosis-Wirkungskurven und damit auch auf den DDREF
Eine Zahl experimenteller Beobachtungen zeigt, dass die Dosis-Wirkungsbeziehungen von Zellen und Geweben von der Linearität abweichen können, insbesondere in dem Bereich niedriger Dosen. Prozesse wie der Adaptive Response, eine erhöhte Zellabtötung nicht direkt getroffener Zellen, und darüber hinaus die induzierte genetische Instabilität, sowohl getroffener als auch von Bystander-Zellen, können alle dazu führen, dass die in vitro beobachteten biologischen Effekte nicht linear zur Strahlendosis verlaufen (vgl. Kapitel 3.1). Die Dosen, bei denen diese Prozesse in vitro gefunden werden, liegen in Bereichen, wo Tierstudien zu unempfindlich sind, um einen Anstieg (oder einen Abfall) über die Spontanrate der Krebsinzidenz hinaus zu demonstrieren. Es gibt also keine experimentelle Evidenz, die für oder gegen diese Prozesse spricht, welche eine Nicht-Linearität der Krebsinduktion bei niedrigen Dosen stützen würden.
3.2.3 Studienarten
3.2.3.1 Der Einfluss des Studiendesigns auf die Krebsinzidenz, die Latenzzeiten und die Mortalität
Es gibt beträchtliche Variationen in der Wachstumsgeschwindigkeit, der Verteilung von Metastasen und der Mortalität bei verschiedenen Tumorarten. Diese Parameter können alle beeinflusst werden durch den Tierstamm, das Geschlecht, das Alter, die Haltungsbedingungen – wie später noch diskutiert wird –, aber sie hängen auch erheblich von der Art der Tierhaltung und dem Versuchskonzept ab. Zum Beispiel werden in einigen Studien über die gesamte Lebenszeit die Tiere zu einem Zeitpunkt getötet, wenn das erste Mal eine Wachstumszunahme des Tumors festgestellt wird. Das kann bedeuten, dass Tiere mit äußerlich sichtbaren langsam wachsenden strahleninduzierten Tumoren mit niedriger Malignität (wie z. B. Osteosarkome oder Plattenzellkarzinome der Haut) in einigen Laboratorien zu einem früheren Zeitpunkt getötet werden, während an anderen Instituten diese Tiere unter Umständen an einem zweiten schneller wachsenden Tumor mit einer längeren Latenzzeit sterben würden. Dieses ist von besonderem Einfluss, wenn der zweite Tumor spontan entsteht, z. B. wie Lymphome in hohem Alter.
In vielen Publikationen sind die angewendeten diagnostischen Kriterien unklar. Zudem ist die Zuordnung der Mortalität zu einem bestimmten Tumor oft schwierig. In den Fällen mehrfacher Tumoren wird oft der besonders augenscheinliche (größte) Tumor als Todesursache angegeben. Nur nach einer sorgfältigen pathologischen Untersuchung kann man die Relevanz jedes Tumors klar bestimmen und die Todesursache korrekt angeben.
Eine alternative Strategie wurde von Fry (Fry 1992) angegeben, die darin besteht, die Tumorart zu vernachlässigen und nur das Ausmaß der Lebensverkürzung als Ausdruck der Gesamtheit aller strahleninduzierten Tumoren zu benutzen. Hier wird der Tod durch den besonders malignen Tumor herbeigeführt, wenn er sich in einem kritischen Organ, z. B. der Lunge, ausbreitet. Das bedeutet, dass Mäuse, die in Bezug auf Metastasen in der Lunge besonders empfindlich sind, eine größere Lebenszeitverkürzung zeigen als Stämme, bei denen diese besondere Anfälligkeit der Lunge nicht vorliegt. An anderer Stelle wird diskutiert, in welcher komplexen Weise Regulationssysteme die Lebenszeit in Tiermodellen bestimmen und wie dieser Parameter (genauso wie die Krebsinzidenz) durch verschiedene andere Variablen verfälscht wird.
3.2.3.2 Der Einfluss der Altersverschiebung bei Expositionen mit chronischer Bestrahlung
Ein besonderes Problem bei dem Vergleich akuter Expositionen mit zeitlich ausgedehnten Bestrahlungen über eine lange Periode ist der Effekt des Alters zum Zeitpunkt der Exposition. Heidenreich u. a. (2006) zeigten, dass bei Anwendung des „2-stages clonal expansion“-Modells (unter der Annahme von LNT) ein DDREF von 2 für Lungentumoren aus der JANUS17-Studie in γ-bestrahlten Mäusen gewonnen werden kann (akute Exposition in einem Alter von 110 Tagen gegenüber einer fraktionierten Bestrahlung über einen Zeitraum von 24 oder 60 Wochen). Die Autoren weisen jedoch darauf hin, dass dasselbe Ergebnis auch durch die niedrigere Inzidenz erklärt werden könnte, die sich dadurch ergibt, dass bei der Langzeit-Bestrahlung der größte Teil der Dosis Mäusen im hohen Lebensalter appliziert wurde. Es wäre angemessener gewesen, den Vergleich mit akuten Bestrahlungen bei Mäusen einer entsprechenden Altersgruppe durchzuführen.
Einen zweiten Kritikpunkt in Bezug auf die fehlende Beachtung des Alters bei der Exposition kann man leicht in Studien erkennen, in denen akute Dosen mit Langzeit-Bestrahlung verglichen werden. Sehr oft wird die akute Dosis den jüngsten Tieren gegeben, während die Zeit, die für eine Langzeit-Bestrahlung benötigt wird, dazu führt, dass die Tiere in einem höheren Lebensalter exponiert werden. Üblicherweise wird nicht sichergestellt, dass akute und Langzeit-Expositionen bei Tieren desselben Alters durchgeführt werden.
3.2.3.3 Unterschiede in der Art der Dosisapplikation
Die Studien mit Mäusen umfassen einen weiten Bereich verschiedener Expositionsmodalitäten, sie erstrecken sich von einer einzigen akuten Dosis bis hin zu einer chronischen Exposition über die gesamte Lebenszeit bei sehr kleinen Dosisleistungen. Zwischen diesen beiden Extremen gibt es eine Vielzahl von Fraktionierungs- und Protaktionsprozeduren, die einen nahezu endlosen Einfallsreichtum demonstrieren.
3.2.3.4 Datenauswertung
Es gibt eine Vielzahl unterschiedlicher Strategien, um die Datensätze von Tierstudien zu normieren und zu korrigieren. Darunter ist die Korrektur für konkurrierende Todesursachen besonders wichtig, da die Tiere nach dem Auftreten eines Tumors normalerweise nicht länger in die Analyse der Inzidenz für spätere Tumortypen eingeschlossen werden. Die Wichtigkeit der Korrektur für konkurrierende Gründe wird am besten illustriert durch Studien von strahleninduzierten Osteosarkomen, die durch Goessner in einem Übersichtsartikel (1999) zusammengefasst wurden. Bei den niedrigsten Dosen treten Osteosarkome in konsistenter Weise deutlich häufiger auf als das maligne fibröse Histiosarkom (malignant fibrous histiosarcoma). Wenn die Dosen erhöht werden, geht der Anteil der Osteosarkome zurück, während die Inzidenz von malignen fibrösen Histiozytomen (malignant fibrous histiocytoma, MFH) ansteigt. Goessner interpretierte diese Verschiebung im Tumorspektrum durch eine Balance zwischen den unterschiedlichen Empfindlichkeiten in Bezug auf die Zellabtötung und die maligene Transformation verschiedener Zelltypen. Dieses ist wichtig, wenn man die Studien von Ullrich und Storer (siehe unten) betrachtet. Die Autoren beobachten hier eine Abnahme der Inzidenz von Retikulumzellsarkomen (follikuläre B-Zell-Lymphome, FBL) mit steigender Strahlendosis, aber zugleich auch einen Anstieg der Inzidenz anderer hämatopoetischer Malignitäten mit der Dosis. Es ist wahrscheinlich, dass die Inzidenz dieser verbreiteten Spontanlymphome aufgrund der Konkurrenz der strahleninduzierten Tumoren abnimmt.
3.2.3.5 Spontane im Vergleich zu induzierten Tumoren
Es ist nahezu unmöglich festzustellen, ob irgendein individueller Tumor durch Strahlung verursacht worden ist. Mögliche Ausnahmen könnte das Auftreten in unnormal frühen oder späten Altersperioden sein (z. B. das Auftreten von Lymphomen viele Monate vor dem Höhepunkt spontaner Lymphome in mit 227Th-bestrahlen Mäusen) oder das Auftreten eines histologischen Typus, der üblicherweise in den beobachteten Tierstämmen nicht festgestellt wird (z. B. Akute myeloische Leukämie [AML], die nur nach einer Bestrahlung in CBA-Mäusen zu finden ist, und Osteosarkome, die nicht als spontane Tumoren in allen üblichen Inzuchtstämmen auftreten).
3.2.3.6 Die Vermengung der Parameter Lebenszeitverkürzung und Krebs als Todesursache
Es muss beachtet werden, dass die Möglichkeiten von Tierstudien für die Beschreibung einer Dosis-Wirkungskurve bei niedrigen Dosen (weniger als 100 mGy) durch das Auftreten endogener spontaner Tumoren begrenzt werden, da auch bei nicht-exponierten Tieren (0 Gray) eine nennenswerte Krebsinzidenz festzustellen ist.
Inzucht-Mausstämme zeigen enorme stammspezifische Unterschiede hinsichtlich der Inzidenz verschiedener Tumorentitäten. Zum Beispiel weisen C3H-Mäuse höhere Lebertumorinzidenzen auf, hingegen BALB/c-Mäuse erhöhte Inzidenzen von Retikulumzell- und Brusttumoren (Jackson Laboratories inbred strain data 2012).
Deshalb ist selbst dann, wenn die Daten mit einer linearen Dosis-Wirkungsbeziehung kompatibel sind, die Aussagekraft von Tierstudien im Hinblick auf die Frage des DDREF im niedrigen Dosisbereich äußerst begrenzt.
3.2.4 Mögliche Fehlschlüsse bei Langzeit-Tierstudien
Bei Studien der Strahlenkarzinogenese in Tieren besteht die besondere Notwendigkeit, dass die experimentellen Bedingungen konstant gehalten werden und zwar über sehr lange Zeitperioden, sogar über Jahre.
3.2.4.1 Qualität der Dosimetrie für die Tierexperimente
Die Expositionsszenarien bei chronischen ausgedehnten oder fraktionierten Studien erfordern eine besondere Sorgfalt, um sicherzustellen, dass die Käfige um die Strahlenquelle rotiert werden und alle Tiere in einem Käfig vergleichbare Dosen erhalten. Ist dies nicht der Fall, dann können Unterschiede in der Bestrahlungsgeometrie die empfangenen Dosen und somit das Resultat beeinflussen. Änderungen in der Strahlenquelle selbst sind unwahrscheinlich. In einigen Studien wird die Strategie beschrieben, die angewandt wurde, um gleichmäßige Bestrahlungen sicherzustellen, andere beziehen sich auf Messungen, um die Einheitlichkeit des Strahlenfelds sicherzustellen, aber in einer Anzahl von Studien werden keine Einzelheiten angegeben.
3.2.4.2 Fluktuationen in der Hintergrundrate
Veränderungen des natürlichen Strahlenhintergrunds sollten bei Studien zur Karziogenese mit akuten Expositionen keine Rolle spielen. Selbst wenn niedrige Dosen angewandt werden, dürfte der Beitrag der Hintergrundstrahlung minimal sein. Bei chronischen Bestrahlungen und kleinen Dosisleistungen ist es möglich, dass Änderungen der Hintergrundstrahlung sowohl die Gesamtdosis als auch die Dosisleistung beeinflussen. Solche Veränderungen könnten infolge unbeabsichtigter Strahlenfreisetzungen in die Umwelt auftreten.
3.2.4.3 Schwankungen (Drift) bei den verwendeten Mäusestämmen
Eine ernstliche Komplizierung bei Studien mit einer großen Anzahl von Tieren ist die Notwendigkeit, regelmäßig neue Tiere in die Studie aufzunehmen, manchmal über eine Periode von Jahren. Eine Anzahl von Inzuchtstämmen zeigt nachweislich eine Kontaminierung mit genetischem Material von anderen Inzuchtstämmen, und es gibt auch Belege für nicht korrekte Paarungen, sogar bei anerkannten Tierzuchtfirmen. Eine Überprüfung der Reinheit der Linie bei Langzeit-Versuchen wird üblicherweise nicht angegeben, obwohl eine intelligente Planung sicherstellen kann, dass solche Vorfälle über alle Test- und Kontroll-Gruppen gleich verteilt sind.
3.2.4.4 Geschlecht
Alle Studien, die hier besprochen werden, machen Unterschiede zwischen männlichen und weiblichen Krebsinzidenzen und Lebenszeiten, da geschlechtsspezifische Inzidenzunterschiede der verschiedenen Tumoren bekannt sind. Ein zu beachtender geschlechtsspezifischer Aspekt ist, dass bei den Männchen einiger Linien aggressives Verhalten beobachtet wird. Die Tierzahl und die Käfiggröße spielen eine wesentliche Rolle, genauso wie das Umsetzen der Tiere von einem Käfig in einen anderen, um Platz zu sparen. Kämpfe und daraus resultierende Verletzungen können einen dramatischen Einfluss auf die Zahl der Tiere haben, die in Langzeit-Studien verloren gehen.
3.2.4.5 Jahreszeiten
Mäuse zeigen eine starke Variation ihrer endokrinen Funktionen mit der Jahreszeit, auch Tumorinzidenz und Lebensspanne werden durch sie beeinflusst. In der Tat zeigte die Studie der AML-Inzidenz von Mole und Mitautoren (Mole et al. 1983) einen achtmonatigen Unterschied in der Lebenszeit von Mäusen in Abhängigkeit von der Jahreszeit. Solche Jahreszeitunterschiede werden nicht immer erkannt oder protokolliert. Wenn Kontroll- und Test-Kohorten zu unterschiedlichen Zeiten in die Studie aufgenommen wurden, so kann es zu abweichenden Werten kommen.
3.2.4.6 Umgebung
Der Originalreport der Lebenszeitstudie des National Cancer Institute in Bezug auf Dosisleistungs- und Dosis-Effekte bei dem Überleben von Mäusen deuten auf ein erhöhtes Überleben der Gruppe mit der niedrigsten Dosis hin, wenn man sie mit nicht-bestrahlten Kontrollen vergleicht. Grahn (1994) wies darauf hin, dass die experimentelle Planung schwerwiegende Mängel aufwies, da die Test-Gruppen und die Kontrollen in unterschiedlichen Gebäuden untergebracht wurden. Die Kontrollen entwickelten eine Dermatitis und wurden nach der Hälfte der Studienzeit durch einen neuen Satz von Kontroll-Tieren ersetzt. Die beobachteten Unterschiede im Überlebensverhalten könnten auf die Strahlenexposition zurückgeführt werden, aber viele weitere Variablen könnten auch durch den Wechsel in der Kontroll-Kohorte verursacht worden sein. Andere Variablen der Umgebung können individuelle Mauslinien in differenzieller Weise beeinflussen, so wie z. B. die Empfindlichkeit in Bezug auf die Belegungsdichte, Wechsel im Streumaterial oder lokale Feuchtigkeit. All dies kann das Langzeit-Überleben beeinflussen und zu unerwarteten experimentellen Beobachtungen führen. Ein Beispiel ist die scheinbare Abnahme der Lebenszeit um 36 % in bis dahin strahlenresistenten C3H-Mäusen, die im Argonne National Laboratory festgestellt wurde, als man zu kleineren Käfigen überging (Grahn 1994).
3.2.4.7 Hygiene
Es ist bekannt, dass der Hygienestatus der Mäuse die Art und die Inzidenzrate spontaner Tumoren beeinflusst, insbesondere bei hämatologischen Krebsarten. Tiere, die in einer keimfreien Umgebung (SPF-Umgebung: Specific Pathogen Free, spezifisch pathogenfreie Tierhaltung) aufwachsen, weisen sehr unterschiedliche Krebsinzidenzen auf, sie leben länger mit niedrigen Inzidenzen maligner Krankheiten, besonders in Bezug auf hämatologische Krebsarten. Dieses Phänomen selbst ist unabhängig von der Zelllinie, alle üblichen Inzuchtstämme zeigen ein verändertes Überlebensverhalten in keimfreier im Vergleich zu unkontrollierter Umgebung. Die Variationen des Ausmaßes dieses Einflusses der SPF-Umgebung zwischen verschiedenen Stämmen könnte auf Variationen in der Immunkompetenz zurückgeführt werden.
Dass dieser Effekt für Strahlenstudien relevant sein kann, wurde in überzeugender Weise durch Untersuchungen von Ina und Sakai (2004, 2005), Ullrich und Storer (1979a, b, c) und Maisin et al. (1996) gezeigt. In den Arbeiten von Ina und Sakai wurde ein Mäusestamm mit verminderter Immunkompetenz eingesetzt, der eine homozygote Inaktivierung des Fas-Gens aufwies, wodurch eine aggressive Autoimmunkrankheit und eine signifikante Verkürzung der Lebenszeit auftraten. Mäuse, die entweder einer kurzzeitigen (fünf Wochen) oder einer lebenslangen chronischen Niedrig-Dosisleistungs-Bestrahlung ausgesetzt waren, zeigten eine signifikante Verlängerung der Lebenszeit, die wahrscheinlich auf eine Aktivierung regulatorischer T-Zellen zurückzuführen ist, wodurch die Autoimmunaktivität verbessert wird (Ina und Sakai 2004, 2005). In den Untersuchungen von Ullrich und Storer im Jahr 1979 führte der Wechsel von Standard-Haltungsbedingungen zu einer spezifischen keimfreien Umgebung zu Veränderungen der strahleninduzierten Inzidenz sowohl von myeloischen (verringert) und thymischen Leukämien (erhöht) (Ullrich und Storer 1979a, b, c und Upton 1970). In ähnlicher Weise führten bei den frühen Manhattan-Studien Änderungen der Tierhaltung zu starken Variationen des Tierüberlebens vor allem aufgrund von Infektionen (Grahn 1994). Maisin et al. (1996) lieferte einen direkten Vergleich der Überlebensraten von SPF-Mäusen mit in dem Labor durchgeführten historischen Studien, wodurch eine Lebensverlängerung durch SPF-Bedingungen belegt wird.
3.2.4.8 Konkurrierende Todesursachen
In jeder Lebenszeitstudie kann es geschehen, dass Tiere während der Auswertung aufgrund des Auftretens von sowohl spontanen als auch strahleninduzierten Tumoren verloren gehen. Es ist klar, dass ein Tier, das im frühen Alter aufgrund eines spontanen Tumors stirbt, nicht im weiteren Verlauf einen strahleninduzierten Tumor im späteren Altersstadium entwickeln kann. Dieses wird am besten illustriert durch die Erfahrung der Studien des Oak Ridge National Laboratory (ORNL), wo die Todesursache aufgrund von spontanen Tumoren und von strahleninduzierten Tumoren eine gegenläufige Abhängigkeit über den untersuchten Dosisbereich zeigt. Es ist heute üblich, die Überlebensdaten der Tiere, die durch irgendeinen Todesgrund ausscheiden, (konkurrierende Todesursachen) zu benutzen, um die Überlebensdaten zu korrigieren, die während der Studie erhoben werden. Die Induktion von Brusttumoren bietet eine ziemlich einmalige Gelegenheit, konkurrierende Todesursachen zu beurteilen, da die Inzidenz von Brusttumoren an die Funktion endokriner Drüsen gekoppelt ist und daher durch das Auftreten langsam wachsender Tumoren des Uterus und der Hypophyse beeinflusst wird. In diesem Fall sterben die Tiere nicht aufgrund von konkurrierenden Ursachen, aber das Auftreten von einem Tumortyp kann die Inzidenz von anderen beeinflussen.
3.2.4.9 Histopathologische Auswertung und Relevanz des Tumortyps in den Tierversuchen in Bezug auf den Menschen
Tumoren, bei denen mechanistische Kenntnisse darauf hinweisen, dass es unwahrscheinlich ist, dass sie aufgrund von Strahlenexpositionen in menschlichen Populationen auftreten, sollten nicht betrachtet werden. Aufgrund dieser Überlegungen sollten quantitative Daten von Dosisleistungs-Effekten bei Lymphomen des Thymus und Ovarialtumoren (Covelli et al.1988), bei denen gezeigt worden ist, dass sie sehr empfindlich auf Dosisleistungs-Effekte reagieren, nicht eingesetzt werden.
In ähnlicher Weise sollte man vorsichtig sein bei der Betrachtung von Daten für die Induktion von Hypophysen-Tumoren in weiblichen RFM-Mäusen wegen der möglichen Effekte, die mit einer Empfindlichkeit der Ovarien der Mäuse und der sich anschließenden Unterbrechung der Hypophysen- und der Eierstockhormonfunktion verbunden sind. Weitere Schwierigkeiten ergeben sich aus den Studien an Ovartumoren von Mäusen; deren Entstehung ist wegen der ovariellen Zykluslänge bei der Maus von vier Tagen und auch wegen deren multipler Eierproduktion nicht mit dem menschlichen Eierstock vergleichbar. Es verbleibt also nur ein begrenzter Datenumfang, auf dessen Grundlage Dosis- und Dosisleistungs-Abhängigkeiten untersucht werden können. Dennoch wurden die Ergebnisse für myeloische Leukämie und einige solide Tumoren eingeschlossen, einschließlich Hardersche Drüse (für die es kein vergleichbares Gewebe beim Menschen gibt), Lungen-Adenokarzinome und Brusttumoren. Daten für myeloische Leukämie gibt es für zwei Mauslinien und von wenigstens drei unabhängigen Studien. Obwohl diese Daten auf einen reduzierten Effekt bei dem Vergleich von Expositionen mit kleinen und großen Dosisleistungen über einen Bereich von 0 Gy bis 3 Gy hinweisen, gibt es Widersprüche. Die Berechnung des DDREF in den vorher beschriebenen Arbeiten geben Abschätzungen in der Größenordnung von 2 bis 6, mit den meisten Werten in dem Bereich 4 bis 5. Für Lungen-Adenokarzinome und Tumoren der Harderschen Drüse kann man einen Wert von ungefähr 3 berechnen bei einem Dosisbereich von 0 Gy bis 2 Gy. Für Brusttumoren weisen alle Daten auf einen DDREF-Wert von weniger als 2 hin. Sie liegen in der Nähe von 1, wenn man die Effekte bei großer und kleiner Dosisleistung im Bereich von 0 Gy bis 2 Gy betrachtet. Es erscheint daher, dass myeloische Leukämie wahrscheinlich empfindlicher auf Dosisleistungs-Effekte reagiert als solide Tumoren.
3.2.5 Fazit
Eine kritische retrospektive Untersuchung von In-vivo-Versuchen an Nager-Modell-Organismen liefert keine Bestätigung für die Einführung eines LDEF oder DREF. Wie kürzlich von Morgan und Bair veröffentlicht wurde, ist die große Stärke von Tierversuchen in mechanistischen Fragestellungen eine Schwäche, wenn sie für den praktischen Strahlenschutz angewandt werden. Denn die kontrollierte Einheitlichkeit in experimentellen Studien repräsentiert nicht die verschiedenen Möglichkeiten von Strahlenexpositionen und die genetische Diversität der Bevölkerung (Morgan und Blair 2013).
Die Studien, auf die zur Stützung des DDREF Bezug genommen wird, untersuchen häufig Endpunkte, wie Tumoren der Harderschen Drüse, die es beim Menschen nicht gibt, oder solche Tumoren, die bei Nagern einen anderen Stoffwechsel aufweisen als beim Menschen (Ovarialtumoren). Die ersten Versuche zielten darauf ab, durch sehr große Tierzahlen eine statistisch ausreichende Aussagekraft zu erreichen. Gleichzeitig litten sie jedoch an methodischen Mängeln, wie z. B. unzureichende Berücksichtigung von anderen Todesursachen als die durch die untersuchten strahleninduzierten Tumoren oder nicht-standardisierte Tierhaltungsbedingungen bzw. unterschiedliche Bestrahlungsszenarien. Diese frühen Studien genügen nicht den gegenwärtigen Standards für vergleichende Untersuchungen, und ihre Aussagekraft ist deshalb sehr begrenzt.
Letztlich muss darauf hingewiesen werden, dass bei einigen der zitierten Arbeiten die Autoren zwar eine linear-quadratische Dosisabhängigkeit angeben, das LNT-Modell jedoch die Daten ebenso gut abbilden könnte.
Literatur
| BEIR 2006 | Committee to Assess Health Risks from Exposure to Low Levels of Ionizing Radiation, Board on Radiation Effects, Research Division on Earth and Life Studies, National Research Council of the National Academies. Health risks from exposure to low levels of ionizing radiation. BEIR VII – Phase 2. United States National Academy of Sciences. National Academy Press, Washington DC. 2006 |
| Covelli et al. 1988 | Covelli V, Coppola M, Di Majo V, Rebessi S, Bassani B. Tumor induction and life shortening in BC3F1 female mice at low doses of fast neutrons and x rays. Radiat Res. 1988;113:362-374 |
| Fry 1992 | Fry RJM. The role of animal experiments in estimates of radiation risks. In: Lett JT, Sinclair WK (eds). Advances in Radiation Research. Academic Press, New York. 1992;181-197 |
| Goessner 1999 | Gössner W. Pathology of radium-induced bone tumours: new aspects of histopathology and histogenesis. Radiat Res. 1999;152(Suppl):12-15 |
| Grahn 1994 | Grahn D. Report ANL-94/26: Studies of Acute and Chronic Radiation Injury at the Biological and Medical Research Division, Argonne National Laboratory, 1953-1970: Description of individual studies, data files, codes, and summaries of significant findings, 1994 |
| Heidenreich et al. 2006 | Heidenreich WF, Carnes BA, Paretzke HG. Lung Cancer Risk in Mice: Analysis of Fractionation Effects and Neutron RBE with a Biologically Motivated Model. Radiat Res. 2006;166:794-801 |
| Ina und Sakai 2004 | Ina Y und Sakai K. Prolongation of life span associated with immunological modification by chronic low dose rate irradiation in MRL-lpr/lpr mice. Radiat Res. 2004;161:168-173 |
| Ina und Sakai 2005 | Ina Y und Sakai K. Further Study of Prolongation of Life Span Associated with Immunological Modification by Chronic Low-Dose-Rate Irradiation in MRL-lpr/lpr Mice: Effects of Whole-Life Irradiation. Radiat Res. 2005;163(4):418-423. doi: http://dx.doi.org/10.1667/RR3316 |
| Maisin et al. 1996 | Maisin JR, Gerber GB, Vankerkom J, Wambersie A. Survival and diseases of C57BL mice exposed to X rays or 3.1 MeV neutrons at an age of 7 or 21 days. Radiat Res. 1996;146:453-460 |
| Mole et al. 1983 | Mole RH, Papworth DG, Corp MJ. The dose-response for x-ray induction of myeloid leukaemia in male CBA/H mice. Br J Cancer. 1983;247:285-291 |
| Morgan und Bair | Morgan WF und Bair WJ. Issues in low dose radiation biology – The controversy continues. A Perspective Radiat Res. 2013;179:501-510 |
| Spalding et al. 1970 | Spalding JF, Popp DM, Popp R. A genetic effect on radiation sensitivity consistent with a single gene locus hypothesis. Radiat Res. 1970;44:670-673 |
| Ullrich und Storer 1979a | Ullrich RL und Storer JB. Influence of gamma irradiation on the development of neoplastic disease in mice. I. Reticuloendothelial tumours. Radiat Res. 1979;80:303-316 |
| Ullrich und Storer 1979b | Ullrich RL und Storer JB. Influence of gamma irradiation on the development of neoplastic disease in mice. II. Solid tumours. Radiat Res. 1979;80:317-324 |
| Ullrich und Storer 1979c | Ullrich RL und Storer JB. Influence of gamma irradiation on the development of neoplastic disease in mice. III. Dose-rate effects. Radiat Res. 1979;80:325-342 |
| Upton et al. 1970 | Upton AC, Randolph ML, Conklin JW, Kastenbaum MA, Slater M, Melville GS Jr, Conte FP, Sproul JA Jr. Late effects of fast neutrons and gamma rays in mice as influenced by the dose rate of irradiation: Induction of neoplasia. Radiat Res. 1970;41:467-491 |
4 Strahlenepidemiologische Studien
Neben strahlenbiologischen Untersuchungen spielen für die Erörterung der Frage, ob ein DDREF notwendig und gerechtfertigt ist, auch epidemiologische Studien eine wichtige Rolle. Auch hier können die Einflüsse einer möglicherweise nicht-linearen Dosisabhängigkeit auf den LDEF und eines möglicherweise vorhandenen Dosisleistungs-Effekts auf den DREF berücksichtigt und getrennt voneinander untersucht werden.
Im Jahre 2009 veröffentlichten Jacob und Mitautoren auf der Basis einer systematischen Literaturrecherche eine Studie, bei der sie aus Einzelstudien zur Mortalität oder Inzidenz nach Exposition mit kleinen Dosisleistungen und niedrigen bzw. moderaten kumulierten Dosen Schätzer des zusätzlichen Risikos pro Dosis ableiteten (Jacob et al. 2009). Dazu verwendeten sie die in den Einzelstudien unter der Annahme einer linearen Dosis-Wirkungsbeziehung abgeleiteten Einzelschätzer des zusätzlichen Risikos pro Dosis und verglichen diese mit dem entsprechenden zusätzlichen Risiko pro Dosis, das sie aus den Daten der Studie an den Atombombenüberlebenden ableiteten. Es wurden also Ergebnisse aus Kohorten mit kleinen Dosisleistungen mit denen einer Kohorte mit großer Dosisleistung verglichen, sodass Informationen zum DREF gewonnen werden konnten. Das Ergebnis dieser Meta-Analyse deutete darauf hin, dass Expositionen mit kleiner Dosisleistung nicht, wie bisher im internationalen Strahlenschutz angenommen, zu einem geringeren Krebsrisiko führen als Expositionen großer Dosisleistungen wie diejenigen, denen die Atombombenüberlebenden ausgesetzt gewesen waren. Demzufolge schließen die Autoren, dass es auf der Grundlage ihrer Untersuchungen keinen Hinweis auf einen DREF > 1 gibt.
Die Bestimmung der Dosis in den untersuchten einzelnen Studien war häufig mit erheblichen Schwierigkeiten verbunden. Hier liegen die Stärken der Studien an den Beschäftigten in Nuklearanlagen, die auf Messdaten der regulären Strahlenschutz-Überwachung zurückgreifen konnten. Bei anderen Studien musste die Dosis dagegen aufwändig rekonstruiert werden (Bewohner des Tetscha-Gebiets, Aufräumarbeiter von Tschernobyl, Bewohner von Kerala und Guangdong), was zu größeren Unsicherheiten bei der Dosisangabe führte. Zudem wurden in einigen Studien interne Expositionen (z. B. durch Tritium, 137Cs, 90Sr etc.) mit berücksichtigt, in anderen traten keine Inkorporationen auf oder wurden bei der Dosisberechnung nicht berücksichtigt. Bei den Beschäftigten in der Nuklearindustrie wurden zudem in manchen Studien Neutronendosen mit berücksichtigt, in anderen Studien nicht. Eine detaillierte Darstellung der Studien findet sich in Anhang B.
Die Ergebnisse von einzelnen Studien müssen auch deshalb mit Vorsicht verglichen und diskutiert werden, weil bei den durchgeführten statistischen Analysen der Daten häufig unterschiedliche Annahmen getroffen wurden. So zeigte sich in einigen Studien (z. B. Ivanov et al. 2009, Cardis et al. 2007), dass die Wahl der Latenzzeit für das Auftreten solider Tumoren die abgeleiteten ERR-Werte pro Dosis deutlich beeinflussen kann. Dies wurde jedoch in den meisten Studien nicht berücksichtigt und eine Latenzzeit von zehn Jahren angenommen. In der Studie an den Beschäftigten in der Nuklearindustrie Japans ergaben sich deutliche Hinweise darauf, dass Alkoholkonsum das Ergebnis maßgeblich beeinflussen kann (Akiba und Mizuno 2012). Dieser Parameter konnte in den meisten hier diskutierten Studien jedoch nicht berücksichtigt werden. Auch das Alter bei Exposition scheint in einigen Studien eine Rolle zu spielen (Cardis et al. 2007, Wing und Richardson 2005, Krestinina et al. 2005), in anderen jedoch nicht, ebenso wie der sozio-ökonomische Status, der nicht immer erhoben wurde.
Vor dem Hintergrund dieser Schwierigkeiten erscheint das Vorgehen von Jacob und Mitautoren sinnvoll, die in ihrer Meta-Analyse systematisch jede der identifizierten Studien einmal in ihrer gemeinsamen Analyse ausschlossen und untersuchten, inwieweit sich der ERR-Wert pro Dosis dadurch änderte. Sie konnten zeigen, dass dies maximal zu einer Änderung von etwa 30 % führte (Jacob et al. 2009). In der hier ebenfalls diskutierten Meta-Analyse von Akiba und Mitautoren wurde dieses Vorgehen ebenfalls, jedoch nicht so systematisch durchgeführt (Akiba und Mizuno 2012).
Im Folgenden werden einige der von Jacob und Mitautoren verwendeten Studien sowie weitere und in den meisten Fällen neuere Studien beschrieben. Generell werden vier Personengruppen betrachtet, bei denen das Risiko für das Auftreten von soliden Tumoren (Inzidenz oder Mortalität) nach Exposition mit niedrigen oder moderaten Dosen und kleinen Dosisleistungen ionisierender Strahlung untersucht wurde: a) Beschäftigte in der Nuklearindustrie verschiedener Länder, b) Bewohner der Tetscha-Gegend im Süd-Ural, die durch das Kernwaffenprogramm der früheren Sowjetunion kontaminiert wurde, c) Bewohner von Gebieten in Kerala in Indien und Guangdong in China, wo eine erhöhte Dosisleistung durch terrestrische Strahlung vorhanden ist, sowie d) Aufräumarbeiter, die in der 30-km-Zone um Tschernobyl eingesetzt worden waren. Zudem wird als einzige Studie zur Exposition mit einer großen Dosisleistung die neueste Auswertung zur Mortalität der Überlebenden der Atombombenabwürfe auf Hiroshima und Nagasaki betrachtet.
Ganz allgemein zeigt sich, dass die meisten Studien an den Beschäftigten in der Nuklearindustrie für die Mortalität durch solide Tumoren einen positiven ERR-Wert pro Dosis liefern, der jedoch statistisch nicht signifikant ist. Ausnahmen sind die Einzel-Studien an den Beschäftigten in der Nuklearindustrie Englands (Muirhead et al. 2009) (0,275 [90 %-KI18: 0,02 – 0,56] Sv–1) und in Oak Ridge (Stayner et al. 2007) (4,82 [90 %-KI: 0,41 – 13,31] Sv–1), bei denen – allerdings nur auf dem 90 %-Level – ein statistisch signifikantes ERR pro Dosis abgeleitet wurde. Ein auf diesem Niveau positiver signifikanter ERR-Wert pro Dosis ergab sich im Falle der Nuklearindustrie Englands auch für die Inzidenz solider Tumoren (0,266 [90 %-KI: 0,04 – 0,51] Sv–1) (Muirhead et al. 2009). Nur zwei Einzelstudien liefern RR-Werte kleiner 1 bei 100 mSv (Boice et al. 2011, Laurent et al. 2010). Entsprechend ergab die gepoolte 15-Länderstudie aus dem Jahre 2005 an Beschäftigten in der Nuklearindustrie einen statistisch signifikanten positiven Schätzer für den ERR-Wert pro Dosis (Cardis et al. 2005). Eine erneute Analyse unter Ausschluss der kanadischen Daten, deren Belastbarkeit angezweifelt wurde, ergab einen reduzierten, nicht signifikanten Wert von 0,58 (95 %-KI: –0,22 – 1,55) Sv–1 (Cardis et al. 2005, 2007). Eine kürzlich veröffentlichte Meta-Analyse aus Japan, in der zum Teil neuere Ergebnisse verwendet wurden, kam ebenfalls zu einem positiven, wenn auch nicht signifikanten Schätzer für den ERR-Wert pro Dosis von 0,14 (95 %-KI: –0,12 – 0,41) Sv–1.
Die aktuellste Studie zur Mortalität der Bevölkerung des Tetscha-Gebietes im Süd-Ural ergab einen signifikant positiven ERR-Wert pro Dosis von 0,92 (95 %-KI: 0,2 – 1,7) Gy–1 (Krestinina et al. 2005, Schonfeld et al. 2013). Einen ähnlichen signifikant positiven ERR-Wert pro Dosis von 1,52 (95 %-KI: 0,20 – 2,85) Gy–1 ergab die aktuellste Analyse der Mortalität der Aufräumarbeiter von Tschernobyl von (Ivanov et al. 2006). Bei beiden Kohorten wurde dieses Ergebnis durch die Analyse der Tumor-Inzidenzdaten bestätigt (Tetscha-Gebiet: 1,0 (95 %-KI: 0,3 – 1,9) Gy–1 (Krestinina et al. 2007); Aufräumarbeiter von Tschernobyl: 0,96 (95 %-KI: 0,28 – 1,72) Gy–1 [Ivanov et al. 2009]).
Dagegen zeigten die Analysen der Inzidenz solider Tumoren in Gegenden erhöhter natürlicher terrestrischer Strahlung in Kerala in Indien einen nicht signifikant negativen ERR-Wert pro Dosis von –0,13 (95 %-KI: –0,58 – 0,46) Gy–1 (Nair et al. 2009), obwohl die mittlere kumulierte Dosis der Studienteilnehmer mit 170 mGy deutlich größer ist als die Dosiswerte, die für die Studien der Nukleararbeiter typisch sind. Ergebnisse einer Studie an der Bevölkerung in Guangdong, einer Gegend mit erhöhter terrestrischer Strahlung in China, ergaben dagegen einen leicht positiven Punktschätzer mit großem Konfidenz-Intervall (0,19 [95 %-KI: –1,87 – 3,04] Gy–1).
In regelmäßigen Abständen wird von der Radiation Effects Research Foundation (RERF) in Japan ein Bericht mit den aktuellsten Ergebnissen der sogenannten Life Span Study (LSS), der epidemiologischen Auswertung der Daten der Atombombenüberlebenden von Hiroshima und Nagasaki, veröffentlicht. Die LSS-Untersuchungen stellen die mit Abstand wichtigste Quelle für Risikoschätzungen in der Strahlenepidemiologie dar. Auch für die Diskussion um den DDREF sind diese Studien von zentraler Bedeutung. Da es sich bei der LSS um Expositionen mit großer Dosisleistung handelt, können auf deren Grundlage lediglich Dosis-Effekte (LDEF), jedoch keine Dosisleistungs-Effekte (DREF) untersucht werden. Die hier diskutierte Veröffentlichung repräsentiert den 14. und aktuellsten Bericht in dieser Reihe mit einem um sechs Jahre längeren Follow-up-Zeitraum (von 1950 bis 2003) gegenüber der vorhergehenden Analyse.
Wurde bei der Analyse dieser Daten der gesamte Dosisbereich berücksichtigt, lieferte eine lineare Dosis-Wirkungskurve den besten Fit der Daten der soliden Tumoren (Abbildung 4.1). Dagegen beobachteten die Autoren für den begrenzten Dosisbereich von 0 Gy bis 2 Gy eine signifikante Krümmung, die sie mit einer linear-quadratischen Kurve anpassen konnten. Diese Krümmung erwies sich als zunehmend ausgeprägter, je länger die Beobachtungszeit seit dem Jahr 1950 beginnend dauerte. Hinweise für eine Dosisschwelle wurden nicht gefunden.
In einer früheren Arbeit, in der die Folgen der Dosisrevision von DS86 auf DS02 untersucht wurde, ergab sich für alle soliden Tumoren zusammen und einem Beobachtungszeitraum von 1950 bis 2000 auf der Basis von DS02 ein ERR-Wert pro Dosis von 0,42 Gy–1 (Preston et al. 2004), was mit dem Ergebnis der vorliegenden Studie übereinstimmt. Auf den ersten Blick scheint die gefundene signifikante Krümmung im Dosisbereich 0 Gy bis 2 Gy für einen DDREF größer 1 zu sprechen („… so that this upward curvature may imply a DDREF greater than one“). Die Autoren betonen jedoch, dass diese Krümmung durch unerklärlich niedrige Werte im Bereich 0,3 Gy bis 0,7 Gy zustande kam, und dass bei noch kleineren Dosen dagegen unerklärlich hohe Werte auftraten.
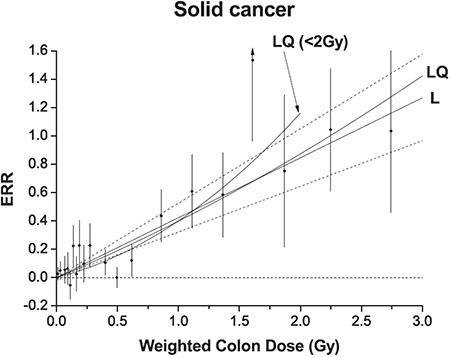
Abbildung 4.1: Zusätzliches relatives Risiko (ERR) für alle Tumoren als Funktion der Dickdarmdosis
(Gamma-Energiedosis plus der mit einem Faktor von 10 gewichteten Neutronen-Energiedosis).
Schwarze Kreise entsprechen ERR-Werten mit den zugehörigen 95 %-Konfidenz-Intervallen
(KI) für die gewählten Dosisgruppen. Durchgezogene Linien: lineares Modell (L) (inkl. 95 %-KI,
dargestellt als gestrichelte Linien) und linear-quadratisches (LQ) Modell, jeweils
für den gesamten Dosisbereich, bzw. linear-quadratisches (LQ(< 2 Gy)) Modell für den
Dosisbereich 0 bis 2 Gy.
Häufig wurden Ergebnisse anderer Studien zur Wirkung niedriger Dosis- und kleiner Dosisleistungswerte mit denen der Life Span Study an den Atombombenüberlebenden verglichen, und dabei der Wert von 0,47 Gy–1 herangezogen, ohne dabei zu berücksichtigen, dass dieser Wert nur für Überlebende mit einem Alter bei Exposition von 30 Jahren und einem erreichten Alter von 70 Jahren, gemittelt über beide Geschlechter, gilt. In der Meta-Analyse von Jacob und Mitautoren wurde diese Tatsache berücksichtigt und für den Vergleich auf der Basis der Atombombenüberlebenden ein ERR-Wert pro Dosis, der an die Alters- und Geschlechtsverhältnisse der jeweiligen Vergleichsstudie angepasst wurde, berechnet.
4.1 Fazit
Die zum gegenwärtigen Zeitpunkt veröffentlichten Ergebnisse epidemiologischer Studien zur Wirkung von Expositionen mit kleiner Dosisleistung ergeben in ihrer Gesamtheit keine Hinweise auf eine Abhängigkeit des Tumorrisikos von der Dosisleistung. Insbesondere liefern sie keine Argumente, die für einen DREF-Wert größer 1 (vgl. Kapitel 2.2) sprechen würden. Die meisten dieser Studien erlauben es jedoch nicht, aus einer Analyse der Dosis-Wirkungsbeziehung Rückschlüsse auf einen LDEF-Wert zu ziehen. Die Studie an den Atombombenüberlebenden, die − wie weiter oben bereits erwähnt − eine Exposition mit großer Dosisleistung darstellt, lässt sich je nach Dosisbereich sowohl durch eine lineare als auch durch eine linear-quadratische Abhängigkeit beschreiben. Ein spezifischer LDEF-Wert im Bereich von etwa 1 bis 2 – wie er derzeit diskutiert wird − lässt sich aus dieser Studie deshalb je nach den betrachteten Dosisbereichen nicht zwingend ableiten.
Literatur
| Akiba und Mizuno 2012 | Akiba S und Mizuno S. The third analysis of cancer mortality among Japanese nuclear workers, 1991-2002: estimation of excess relative risk per radiation dose. J Radiol Prot. 2012;32:73-83 |
| Boice et al. 2011 | Boice JD, Jr., Cohen SS, Mumma MT, Ellis ED, Eckerman KF, Leggett RW, Boecker BB, Brill AB, Henderson BE. Updated Mortality Analysis of Radiation Workers at Rocketdyne (Atomics International). Radiat Res. 2011;176:244-258 |
| Cardis et al. 2005 | Cardis E, Vrijheid M, Blettner M, Gilbert E, Hakama M, Hill C, Howe G, Kaldor J, Muirhead CR, Schubauer-Berigan M, Yoshimura T, Bermann F, Cowper G, Fix J, Hacker C, Heinmiller B, Marshall M, Thierry-Chef I, Utterback D, Ahn YO, Amoros E, Ashmore P, Auvinen A, Bae JM, Solano JB, Biau A, Combalot E, Deboodt P, Diez Sacristan A, Eklöf M, Engels H, Engholm G, Gulis G, Habib R, Holan K, Hyvonen H, Kerekes A, Kurtinaitis J, Malker H, Martuzzi M, Mastauskas A, Monnet A, Moser M, Pearce MS, Richardson DB, Rodriguez-Artalejo F, Rogel A, Tardy H, Telle-Lamberton M, Turai I, Usel M, Veress K. Risk of cancer after low doses of ionising radiation: retrospective cohort study in 15 countries. BMJ. 2005;331(7508):77 |
| Cardis et al. 2007 | Cardis E, Vrijheid M, Blettner M, Gilbert E, Hakama M, Hill C, Howe G, Kaldor J, Muirhead CR, Schubauer-Berigan M, Yoshimura T, Bermann F, Cowper G, Fix J, Hacker C, Heinmiller B, Marshall M, Thierry-Chef I, Utterback D, Ahn YO, Amoros E, Ashmore P, Auvinen A, Bae JM, Bernar J, Biau A, Combalot E, Deboodt P, Diez Sacristan A, Eklöf M, Engels H, Engholm G, Gulis G, Habib RR, Holan K, Hyvonen H, Kerekes A, Kurtinaitis J, Malker H, Martuzzi M, Mastauskas A, Monnet A, Moser M, Pearce MS, Richardson DB, Rodriguez-Artalejo F, Rogel A, Tardy H, Telle-Lamberton M, Turai I, Usel M, Veress K. The 15-Country Collaborative Study of Cancer Risk among Radiation Workers in the Nuclear Industry: Estimates of Radiation-Related Cancer Risks. Radiat Res. 2007;167:396-416 |
| Ivanow et al. 2006 | Ivanow VK, Tumanov KA, Kashcheev VV, Tsyb AF, Marchenko TA, Chekin SY, Maksioutov MA, Petrov AV, Biryukov AP. Mortality in Chernobyl clean-up workers: analysis of dose-effect relationship. Radiation and Risk. 2006;15:11-22 (Russian) |
| Ivanow et al. 2009 | Ivanov VK, Gorsky AI, Kashcheev VV, Maksioutov MA, Tumanov KA. Latent period in induction of radiogenic solid tumors in the cohort of emergency workers. Radiat Environ Biophys. 2009;48:247-252 |
| Jacob et al. 2009 | Jacob P, Rühm W, Walsh L, Blettner M, Hammer G, Zeeb H. Cancer risk of radiation workers larger than expected? Occup. Environ. Med. 2009 Jun 30 published online; doi:10.1136/oem.2008.043265 |
| Krestinina et al. 2005 | Krestinina LY, Preston DL, Ostroumova EV, Degteva MO, Ron E, Vyushkova OV, Startsev NV, Kossenko MM, Akleyev AV. Protracted radiation exposure and cancer mortality in the Techa River Cohort. Radiat Res. 2005;164:602-611 |
| Krestinina et al. 2007 | Krestinina LY, Davis F, Osroumova EV, Epifanova SB, Degteva MO, Preston DL, Akleyev AV. Solid cancer incidence and low-dose-rate radiation exposure in the Techa River cohort: 1956-2002. Int J Epid. 2007;36:1038-1046 |
| Laurent et al. 2010 | Laurent O, Metz-Flamant C, Rogel A, Hubert D, Riedel A, Garcier Y, Laurier D. Relationship between occupational exposure to ionizing radiation and mortality at the Frenc electricity company, period 1961-2003. Int Arch Occup Environ Health. 2010;83:935-944 |
| Muirhead et al. 2009 | Muirhead CR, O’Hagan JA, Haylock RGE, Phillipson MA, Willcock T, Berridge GLC, Zhang W. Mortality and cancer incidence following occupational radiation exposure: third analysis of the National Registry for Radiation Workers. Brit. J. Cancer. 2009;100:206-212 |
| Ozasa et al. 2012 | Ozasa K, Shimizu Y, Suyama A, Kasagi F, Soda M, Grant EJ, Sakata R, Sugiyama H, Kodama K. Studies of the mortality of atomic bomb survivors, Report 14, 1950-2003: An overview of cancer and noncancer diseases. Radiat Res. 2012;177:229-243 |
| Preston et al. 2004 | Preston DL, Pierce DA, Shimizu Y, Cullings HM, Fujita S, Funamoto S, Kodama K. Effect of recent changes in atomic bomb survivor dosimetry on cancer mortality risk estimates. Radiat Res. 2004;162:377-389 |
| Schonfeld et al. 2013 | Schonfeld SJ, Krestinina LY, Epifanova S, Degteva MO, Akleyev AV, Preston DL. Solid Cancer Mortality in the Techa River Cohort (1950-2007). Radiat Res. 2013;179:183-189 |
| Stayner et al. 2007 | Stayner L, Vrijheid M, Cardis E, Stram DO, Deltour I, Gilbert SJ, Howe G. A Monte Carlo Maximum Likelihood Method for Estimating Uncertainty Arising from Shared Errors in Exposures in Epidemiological Studies of Nuclear Workers. Radiat Res. 2007;168:757-763 |
| Wing und Richardson 2005 | Wing S und Richardson DB. Age at exposure to ionising radiation and cancer mortality among Hanford workers: follow up through 1994. Occup.Environ.Med. 2005;62:465-472 |
5 Wissenschaftliche Grundlagen und weitere strahlenschutzrelevante Kriterien zur Beurteilung des DDREF
Wissenschaftliche Grundlagen
Der DDREF wurde eingeführt zur Ermittlung von Strahlenrisiken im niedrigen Dosis- und kleinen Dosisleistungsbereich auf der Basis von Untersuchungen bei hohen Dosen bzw. großen Dosisleistungen. Eine Beurteilung, inwieweit die Anwendung eines DDREF gerechtfertigt ist und welcher Wert ihm zugeordnet werden sollte, basiert auf wissenschaftlichen Erkenntnissen über das Strahlenrisiko in unterschiedlichen Dosisbereichen und bei unterschiedlichen Dosisleistungen. Diese Erkenntnisse ergeben sich aus einer Reihe verschiedener Forschungsbereiche und erfordern letztlich eine Abwägung, welche Forschungsergebnisse und welche Kriterien mit welcher Priorität zur Beurteilung herangezogen werden sollen. Im Folgenden werden diese aufgeführt:
- –
-
Strahlenbiologische Untersuchungen an molekularen und zellulären SystemenIn den letzten 50 Jahren bildeten die Ergebnisse von strahlenbiologischen Untersuchungen die wesentliche Basis für die Festlegung eines DDREF, die meist, aber nicht ausschließlich, auf Studien im Bereich von einigen Gy beruhen. Dabei wurden zur Bestimmung von Dosis- und Dosisleistungs-Abhängigkeiten u. a. Untersuchungen an einzelnen Zellen oder Zellkulturen durchgeführt. Diese Daten werden auch heute noch als die wichtigste Quelle für die Rechtfertigung eines DDREF größer als 1 herangezogen, auch wenn diese Studien sich auf hohe Dosen beziehen. Weiterhin ist es offen, ob bzw. wie die Ergebnisse auf die Situation der Tumorinduktion beim Menschen übertragbar sind. Dies gilt insbesondere in Bezug auf neuere Befunde wie zum Beispiel Bystander-Effekt, genomische Instabilität und Adaptive Response und deren Bedeutung für die Strahlenwirkung bei niedrigen Dosen und kleinen Dosisleistungen. Ein Teilaspekt bei diesen Untersuchungen ist die Frage, ob Dosis-Effekte (Abweichung von einer linearen Dosis-Wirkungsbeziehung) und Dosisleistungs-Effekte gekoppelt sind oder ob sie unabhängig voneinander betrachtet werden müssen.
- –
-
Strahlenbiologische Untersuchungen an TierenTierexperimente gehen in die Diskussion für die Festlegung eines DDREF ein. Diese werden überwiegend an Mäusen oder Ratten durchgeführt, wobei im Einzelnen eine Reihe von verschiedenen Endpunkten (Lebenszeitverkürzung, Tumorinzidenz, Tumormortalität usw.) beobachtet wird. Wenngleich auch hier offen bleibt, inwieweit die Ergebnisse auf die Tumorinduktion beim Menschen übertragbar sind, entspricht die Bestrahlung eines ganzen Organismus eher der Situation beim Menschen als die Bestrahlung von einzelnen Zellen. Es ist jedoch zu beachten, dass bei Untersuchungen an Tieren das Studiendesign (Endpunkte) und die zahlreichen Einflussparameter bei der Durchführung der Studien das Ergebnis erheblich beeinflussen und eine generelle Aussage zum DDREF erschweren.
- –
-
Epidemiologische StudienEpidemiologische Daten sind ebenfalls eine wichtige Quelle zur Ermittlung eines DDREF, insbesondere da sie sich direkt auf Krebserkrankungen beim Menschen beziehen. Auch epidemiologische Studien erlauben die Untersuchung von Dosis-Effekten (LDEF)19 und Dosisleistungs-Effekten (DREF)20 sowie die Frage, ob diese unabhängig voneinander sind. Während Dosis-Wirkungsbeziehungen im Prinzip bei der Untersuchung einer einzelnen exponierten Kohorte (z. B. die mit unterschiedlichen Dosen exponierten Überlebenden in Hiroshima und Nagasaki) ermittelt werden können (LDEF), sind zur Untersuchung des Dosisleistungs-Effekts (DREF) normalerweise vergleichende Studien an verschiedenen Populationen notwendig, die mit unterschiedlichen Dosisleistungen exponiert wurden. Die Aussagekraft gegenwärtiger epidemiologischer Studien zum Risiko von strahlenbedingten Krebserkrankungen ist bei Expositionen im Dosisbereich von einigen 10 mSv im Gegensatz zum Bereich oberhalb von 100 mSv gering. Studien im Bereich kleiner Dosisleistungen erfordern in der Regel lange Expositions- bzw. Beobachtungsdauern. Dies erschwert belastbare Aussagen zur Wirkung kleiner Dosisleistungen. In den letzten Jahren sind allerdings eine Reihe von Studien im mittleren Dosis- und Dosisleistungsbereich hinzugekommen, die eine genauere Beurteilung erlauben. Durch die Zusammenfassung von Einzelstudien in Meta-Analysen kann die Situation weiter verbessert werden.
- –
-
Mechanistische strahlenbiologische ModelleUm zu Aussagen für den im Strahlenschutz wichtigen Bereich niedriger Dosen und kleiner Dosisleistungen zu gelangen, ist man auf Extrapolationen von hohen Dosisbereichen angewiesen. Solche Extrapolationen erfolgen häufig auf der Grundlage mathematisch formulierter mechanistischer Modelle. Diese spielen bei der Interpretation experimenteller und epidemiologischer Daten eine erhebliche Rolle. Dazu zählt beispielsweise die Annahme einer rein linearen oder einer linear-quadratischen Dosis-Wirkungsbeziehung. Darüber hinaus ist es wegen des Hintergrundrisikos bei der Auswertung epidemiologischer Daten wichtig, ob ein multiplikatives, additives oder gemischtes Risikomodell zur Anwendung kommt. Auch die Frage, in welchem Umfang Alters- und Geschlechtsabhängigkeiten (bis hin zu individuellen Merkmalen) des Strahlenrisikos zu berücksichtigen sind, beeinflusst die Abschätzung von Risikokoeffizienten. Bei der Frage, welches Modell vorliegende experimentelle bzw. epidemiologische Daten am besten beschreibt, spielt die Unsicherheit der Daten eine erhebliche Rolle. In der Regel sind die Daten im Bereich der niedrigsten betrachteten Dosen und kleinsten Dosisleistungen mit den größten Unsicherheiten behaftet. Dies schränkt die Entscheidungsmöglichkeiten, welches Modell die Daten am besten beschreibt, stark ein und führt zu erheblichen Unsicherheiten bei der modellabhängigen Ermittlung eines DDREF.
Kriterien zu Anforderungen des Strahlenschutzes für die operationelle Umsetzung
Eine Beurteilung, ob der derzeitige im Strahlenschutz zur Abschätzung des Strahlenrisikos allgemein angewandte DDREF-Wert – wie in der Vergangenheit bereits mehrfach geschehen – geändert werden sollte, basiert nicht ausschließlich auf den genannten wissenschaftlichen Erkenntnissen im engeren Sinne, sondern bezieht maßgeblich auch weitere Kriterien ein, die sonstige wichtige Aspekte des Strahlenschutzes und die praktische Umsetzung betreffen. Eine Beurteilung lediglich auf der Basis wissenschaftlicher Grundlagen und Kriterien wird der Bedeutung und Funktion des DDREF nicht gerecht. Daher werden zusätzlich zu den wissenschaftlichen Erkenntnissen auch die folgenden Kriterien zur Beurteilung herangezogen:
- –
-
Einfluss von UnsicherheitenDie Unsicherheiten von ermittelten Risikowerten und einem daraus abgeleiteten DDREF sind erheblich und führen dazu, dass man lediglich einen Bereich von DDREF-Werten (zur Debatte stehende Werte etwa zwischen 1 und 2) angeben kann, der mit den experimentellen und epidemiologischen Daten verträglich ist. Die Überlegungen zur Änderung des bisher verwendeten DDREF-Werts von 2 dürfen deshalb den Gesichtspunkt der Unsicherheit nicht außer Acht lassen. Es ist zu entscheiden, ob die gegenüber früher verbesserte Datenlage (und damit reduzierte Unsicherheit) heute noch Anlass zur Einführung eines DDREF geben würde (wenn es einen solchen noch nicht gäbe) oder ob die Unsicherheiten nach wie vor so erheblich sind, dass für eine Abschaffung eines bereits bestehenden DDREF nicht genügend Aussagekraft besteht.
- –
-
Umsetzung in den praktischen StrahlenschutzKontinuität, Konsens, Nachvollziehbarkeit und Akzeptanz sind ein hohes Gut im Strahlenschutz. Häufige Wechsel von Konzepten und Vorschriften können insbesondere bei der Umsetzung in die Praxis zu Verunsicherungen führen, die im Strahlenschutz kontraproduktiv sind, und daher, wenn immer möglich, vermieden werden sollten. Änderungen sollten nur dann angestrebt werden, wenn sie hinreichend wissenschaftlich begründbar sind und wenn damit tatsächlich eine deutliche Verbesserung des Strahlenschutzes beispielsweise im Sinne einer besseren Schutzwirkung bzw. eines größeren Nutzen-Risiko-Verhältnisses erzielt werden kann.
- –
-
Internationale EinbindungDie gegenwärtige Konzeption des Strahlenschutzes ist das Resultat eines weltweiten und andauernden historischen Prozesses. Der seit jeher bemerkenswert hohe Grad an internationaler Übereinstimmung in den Strahlenschutzregelungen ist auch das Ergebnis der ständigen Bemühung um einen möglichst breiten internationalen Konsens. Dieser weitreichende Konsens umfasst auch die Einschätzungen über die wissenschaftliche Basis des Strahlenschutzes, wie beispielsweise die Erkenntnisse über die Strahlenbiologie und Strahlenwirkung oder Fragen der Konservativität im Strahlenschutz. Eine aktive Beteiligung an der internationalen Konsensbildung ist ein wichtiger Aspekt.
- –
-
Konsequenzen für GrenzwertfestsetzungDer Strahlenschutz mit seinen konzeptionellen „Grundsäulen“ Rechtfertigung, Optimierung und Begrenzung ist so robust ausgelegt, dass quantitative Schwankungen einer der implementierten Größen (z. B. des DDREF, der Wichtungsfaktoren) nicht notwendigerweise zu Änderungen der Grenzwertsetzung führen müssen, könnten allerdings Anlass zu Diskussionen hierüber geben. Es würde dabei zwangsläufig das Problem berührt, dass die Festlegung der Grenzwerte für beruflich strahlenexponierte Personen sich auf Argumentationslinien stützt, für die der Wert des Strahlenrisikos, und damit der DDREF, eine weit größere Rolle spielt als bei dem Grenzwert für die allgemeine Bevölkerung. Bei ihr wird die Festlegung des Grenzwerts im Wesentlichen damit begründet, dass er im Schwankungsbereich der natürlichen Strahlenexposition liegt und im Bereich von 1 mSv keine Risikoaussagen gemacht werden können.
- –
-
RisikokommunikationDas Strahlenrisiko ist in der öffentlichen Wahrnehmung geprägt von besonderer Sensibilität. Dabei wird die öffentliche Diskussion bezüglich der Wirkung von Strahlung und der Höhe der Strahlenrisiken häufig von Fehleinschätzungen bestimmt. Daher muss bei jeder Neubewertung eine sorgfältige und umfassende Kommunikation gewährleistet sein.Voraussetzung für eine erfolgreiche Kommunikation ist Vertrauen der Öffentlichkeit in die Glaubwürdigkeit der wissenschaftlichen Gremien. Glaubwürdigkeit kann nicht zuletzt dadurch erreicht werden, dass Hinweise, die auf höhere Risiken hindeuten, aufgegriffen und ausführlich diskutiert werden. Die Diskussion und Kommunikation muss in einem Kontext und in einer Form erfolgen, der es der Öffentlichkeit erlaubt, den Stellenwert neuer wissenschaftlicher Erkenntnisse beurteilen zu können.21
6 Zusammenfassende Beurteilung
Eine Aussage zum DDREF auf der Grundlage strahlenbiologischer Untersuchungen an Zellkulturen führt zu keinem einheitlichen Bild. Auf molekularer und zellulärer Ebene (In-vitro-Studien) lässt sich eine Vielzahl von linearen und nicht-linearen Effekten beobachten. Während Effekte auf „früher“ Wirkungsebene, wie beispielsweise Energiedeposition, Doppelstrangbrüche und andere strahleninduzierte DNA-Schäden eher linear mit der Dosis zusammenhängen, scheinen komplexere, „spätere“ Wirkungen, wie Chromosomen-Aberrationen, Reparaturvorgänge und andere Effekte auf nachfolgender Wirkungsebene zumindest teilweise nicht-lineare Dosis-Wirkungskomponenten aufzuweisen. Es kommt hinzu, dass im Bereich niedriger Dosen andere biologische Mechanismen wirken als im hohen Dosisbereich. Abhängigkeiten von der Dosisleistung können bei einer Reihe von Effekten beobachtet werden. Es gibt keine eindeutigen Hinweise für einen Zusammenhang zwischen Dosis- und Dosisleistungs-Effekten. Sie können demzufolge als weitgehend „entkoppelt“ voneinander betrachtet werden.
Die Wirkungen bei Untersuchungen an Tieren zeigen große Variabilität. Eindeutige Dosis-Wirkungszusammenhänge im Bereich niedriger Dosen oder Dosisleistungsabhängigkeiten lassen sich nicht ermitteln. Insgesamt ergeben sich jedoch bei Tierexperimenten wenig Hinweise auf eine generelle Abweichung von einer linearen Dosis-Wirkungsbeziehung oder auf eine generelle Dosisleistungsabhängigkeit.
Bisher galten strahlenbiologische Experimente als Hauptstütze zur Argumentation für einen DDREF-Wert größer als 1. Nicht-Linearitäten in Dosis-Wirkungsbeziehungen und Dosisleistungsabhängigkeiten werden nach wie vor auch in aktuellen Studien beobachtet. Je nach biologischem Endpunkt findet man eine große Bandbreite von unterschiedlichen Dosis-Wirkungsabhängigkeiten.
Gegenwärtig ergibt ein Vergleich der aktuellsten Ergebnisse von epidemiologischen Studien bei kleinen und großen Dosisleistungen in seiner Gesamtheit keinen Hinweis auf eine Abhängigkeit des Tumorrisikos von der Dosisleistung, also auf einen DREF-Wert größer 1. Die meisten der zu kleinen Dosisleistungen durchgeführten Studien verwenden bei der Analyse eine lineare Dosis-Wirkungsbeziehung. Deshalb können daraus keine Rückschlüsse auf eine Form der Dosis-Wirkungskurve und damit auf einen bestimmten LDEF-Wert gezogen werden. In der aktuellsten Studie an den Atombombenüberlebenden, die eine Untersuchung der Wirkung großer Dosisleistungen darstellt, lässt sich nicht eindeutig zwischen verschiedenen Formen der Dosis-Wirkungsbeziehung (z. B. linear oder linear-quadratisch) unterscheiden, sodass sich auch gegenwärtig daraus kein LDEF-Wert zwingend ableiten lässt.
Mechanistische Modelle können im Prinzip die Möglichkeit bieten, einen funktionellen Zusammenhang zwischen Wirkung und Dosis abzuleiten. Sie spielen daher bei der Extrapolation vom Bereich hoher Dosen zu niedrigen Dosen eine große Rolle. Ursprünglich war auch der linear-quadratische Dosis-Wirkungszusammenhang als mechanistisches Modell entworfen worden und bildete damit ein starkes Indiz für einen DDREF > 1. Auch wenn dieses Modell mittlerweile kaum mehr den Anspruch erhebt, einen Wirkungsmechanismus realistisch zu beschreiben, hat es doch einen Teil seiner Bedeutung behalten.
Mechanistische Modelle bilden jedoch in der Regel nur einen Ausschnitt aus dem äußerst komplexen und noch weitgehend unbekannten Wirkungsablauf zwischen Primärereignis (Ionisation) und Endpunkt (Krebserkrankung) ab. Es ist kaum davon auszugehen, dass der Gesamtablauf des Prozesses der Kanzerogenese durch eines dieser Modelle, wenn es über einen bloßen Datenfit hinausgehen soll, beschrieben werden kann. Daher können auch Modellbildungen nur eingeschränkt zur Entscheidung herangezogen werden, welcher Wert für einen DDREF angemessen ist.
Unsicherheiten haben maßgeblichen Einfluss auf die Begründung für einen DDREF. Keines der wissenschaftlichen Kriterien reicht für sich allein aus, einen eindeutigen Wert für den DDREF zu liefern. Vielmehr führen die vielfältigen Variabilitäten der verschiedenen Studienansätze und ihrer Ergebnisse sowie deren Unsicherheiten dazu, dass ein DDREF-Wert lediglich auf einen Wertebereich unterhalb von 2 beschränkt werden kann. Die Auswertung der wissenschaftlichen Erkenntnisse erlaubt jedoch keine weitere Eingrenzung des DDREF.
Wie in Kapitel 2 erläutert wurde, ist der DDREF eine in ihrer Bedeutung und in ihrer Funktion sehr subtile konzeptionelle Größe. Tatsächlich spricht bei Anwendung der wissenschaftlichen Kriterien einiges dafür, dass auf der Grundlage der heutigen wissenschaftlichen Erkenntnisse und der großen Unsicherheit des Strahlenrisikos bei niedrigen Dosen ein solcher Faktor nicht eingeführt würde, wenn er nicht bereits bestünde. Die Gewährleistung einer möglichst großen Kontinuität im Strahlenschutz führt dann zu der Frage, ob eine nach aktueller wissenschaftlicher Beurteilung weniger starke Evidenz für einen DDREF dessen Abschaffung mit den daraus möglichen resultierenden Konsequenzen ausreichend rechtfertigen kann oder ob die Unsicherheiten einen nicht entscheidbaren und daher zur Debatte stehenden Wertebereich zwischen 1 und 2 zulassen. Darüber hinaus ist zu bemerken, dass das konzeptionelle Gebäude des Strahlenschutzes auf den drei Grundprinzipien „Rechtfertigung“, „Optimierung“ und „Begrenzung“ und damit in seinen wesentlichen Elementen nicht auf der genauen Kenntnis des Strahlenrisikos bei niedrigen Dosen beruht.
Vor dem Hintergrund des oben skizzierten Kontinuitätskriteriums erfordert die Umsetzung in den praktischen Strahlenschutz eine besonders sorgfältige Abwägung, ob der DDREF-Wert geändert werden soll. Eine derartige Abwägung sollte nur im internationalen Konsens erfolgen.
Auf der Grundlage aktueller wissenschaftlicher Erkenntnisse sieht die SSK keine ausreichende Begründung mehr für den im Strahlenschutz verwendeten DDREF. Wenn allerdings aus wissenschaftlichen Gründen eine Verkleinerung bzw. Abschaffung des DDREF erwogen wird, so muss begründet werden, dass dieses wissenschaftliche Motiv ausreichend ist, insbesondere dann, wenn nicht eindeutig und nachvollziehbar angegeben werden kann, was das für die Verbesserung des Strahlenschutzes bedeutet. Andererseits ist zu prüfen, inwieweit eine mögliche Unterschätzung des Krebsrisikos bei niedrigen Dosen und kleinen Dosisleistungen mit dem Vorsorgeprinzip im Strahlenschutz verträglich ist.
Für die SSK hat die wissenschaftliche Basis ihrer Stellungnahmen und Empfehlungen einen hohen Stellenwert. Nach Auffassung der SSK stellt eine möglichst große wissenschaftliche Objektivität und das permanente Bemühen um die Berücksichtigung aller aktuellen Forschungsergebnisse die Voraussetzung dafür dar, das notwendige Vertrauen der Bevölkerung in die Bewertungen der SSK zu erhalten und zu verstärken. Dies sieht die SSK auch bei einer Anpassung des DDREF auf der Basis neuer wissenschaftlicher Erkenntnisse. Über die Verpflichtung zur wissenschaftlichen Objektivität hinaus sieht die SSK ihre Aufgabe jedoch auch darin, Probleme in der öffentlichen Wahrnehmung zu beachten und ihnen durch eine intensive und andauernde Kommunikation Rechnung zu tragen.
Die für den Strahlenschutz wichtigsten Größen sind der mit einer Strahlenexposition verbundene Schaden (Krebsentstehung und genetische Veränderungen) und dessen Eintrittswahrscheinlichkeit. Als Maß hierfür gilt das sogenannte „Detriment“ (gesundheitlicher Schaden), eine gewichtete Schadenswahrscheinlichkeit, in die u. a. die Risikokoeffizienten (unter Einbeziehung eines DDREF) eingehen (siehe Kapitel 1.2). Das Detriment beinhaltet aber auch eine Reihe weiterer Parameter, wie z. B. die Überlebenswahrscheinlichkeit, die Lebensqualität und der Verlust an Lebenserwartung. Diese Parameter unterliegen einer zeitlichen Entwicklung. Verbesserte Lebensbedingungen und Fortschritte in der Medizin könnten beispielsweise dazu führen, dass sich die Überlebenswahrscheinlichkeit bei einer Krebserkrankung erhöht, die Lebensqualität verbessert und der Verlust an Lebenserwartung verkleinert. Alle diese Parameter müssen bei der weiteren Bewertung der gesundheitlichen Auswirkungen einer bestimmten Strahlenexposition berücksichtigt werden. Eine isolierte Betrachtung des Risikokoeffizienten bzw. des DDREF wird der Gesamtsituation nicht gerecht.
Im Zusammenhang mit der Entscheidung für eine Änderung des DDREF spielt dieser Gesichtspunkt insofern eine Rolle, dass beide Effekte in komplexer Weise zusammenwirken und dies eine kompensatorische Tendenz aufweisen könnte: Die Abschaffung des DDREF würde für sich gesehen zu einer Erhöhung des strahleninduzierten Detriments führen, die Anpassung der oben genannten Parameter an die aktuellen Statistiken könnte dagegen eine Erniedrigung des Detriments zur Folge haben.
Empfehlung der Strahlenschutzkommission
Auf der Grundlage aktueller wissenschaftlicher Erkenntnisse sieht die SSK keine ausreichende Begründung mehr für den im Strahlenschutz verwendeten DDREF.
Die SSK empfiehlt, aufgrund der in diesem Bericht aufgeführten Bewertungen den DDREF an die neueren Erkenntnisse anzupassen und gegebenenfalls abzuschaffen.
Aufgrund seiner Bedeutung für die Risikobewertung und die Konsequenzen für den Strahlenschutz empfiehlt die SSK darüber hinaus, im Zuge dieser Anpassung auch alle anderen Parameter, die in das Detriment, d. h. in die Angabe des Strahlenschadens eingehen, an den aktuellen wissenschaftlichen Stand anzupassen.
Die SSK hält eine internationale Abstimmung in diesen Fragen für dringend erforderlich und empfiehlt daher, ihre Einschätzung in die internationale Diskussion einzubringen.
Anhang A zu Kapitel 3.2 „In-vivo-Studien“
Neu-Interpretationen von größeren Studien als Grundlage zur Bewertung von Dosis- und Dosisleistungs-Effekten:
Die folgende Übersicht beschränkt sich auf groß angelegte Dosis- und Dosisleistungs-Studien mit Inzuchtstämmen der Maus (siehe auch Tabelle A.1 und Tabelle A.2).
A.1 Studien zum Effekt der Dosis
A.1.1 Studien des Oak Ridge National Laboratory (ORNL) zur Lebenszeitverkürzung von RFM-Mäusen (ORNL-1, ORNL-2) (Storer et al. 1979)
Diese groß angelegten Tierstudien, die im Oak Ridge National Laboratory (ORNL) durchgeführt wurden, werden im Allgemeinen in Kommissionsentscheidungen über DDREF zitiert. Die Lebensdauer von 30 000 RFM-Mäusen und 11 000 BALB/c-Mäusen wurde unter keimfreien Bedingungen (SPF: Specific Pathogen Free, spezifisch pathogenfreie Tierhaltung) untersucht. Sowohl Hoch- als auch Niedrig-LET-Strahlung (137Cs-Quellen) wurden bei verschiedenen Dosen und Dosisleistungen untersucht.
Studienplanung und Durchführung
Männliche und weibliche RFM-Mäuse sowie geringere Zahlen an weiblichen BALB/c-Tieren wurden im Alter von zehn Wochen akuten Einzeldosen ausgesetzt, die mit einer Dosisleistung zwischen 400 mGy/min und 450 mGy/min appliziert wurden. Die Strahlenwirkung wurde ohne Diagnose der Todesursache sowohl als Lebenszeitverkürzung als auch als Todesinzidenz als Funktion des Alters angegeben. Die Analyse der Wirkungen einer Dosis von 750 mGy in weiblichen RFM-Mäusen zeigte, dass die Lebenszeitverkürzung überwiegend auf eine höhere Todesrate im ersten Jahr nach der Strahlenexposition zurückgeführt werden kann. Dies ist ein Hinweis, dass ein früher Tod durch eine verkürzte Latenzzeit bereits bestehender Erkrankungen oder durch die Induktion von Erkrankungen mit frühem Ausbruch begründet sein könnte.
Ergebnisse der Studie
Es sollte nicht überraschen, dass akute Dosen über 250 mGy die Lebenserwartung sowohl von männlichen als auch weiblichen RFM-Mäusen verkürzten. Die Dosis-Wirkungsbeziehungen zwischen Lebenszeitverkürzung und Dosis wurde für männliche und weibliche RFM-Mäuse und ebenso für weibliche BALB/c-Mäuse für alle Dosen über 500 mGy linear dargestellt. Nur für die niedrigsten Dosen von 100 mGy und 250 mGy zeigte sich eine Abweichung von der Linearität. Bei diesen niedrigen Dosen war die Todesrate nicht von der sporadischen Todesrate zu
unterscheiden. Die Extrapolation der Dosis-Wirkungskurve, die mit Daten aus dem linearen Bereich berechnet wurde, überlagerte sich mit der sporadischen Rate bei der Dosis Null.
Diskussion
Diese Studie belegt für männliche und weibliche RFM-Mäuse eine lineare Dosis-Wirkungsbeziehung bei Expositionen von 500 mGy bis 3 Gy. Nicht-Linearität findet sich nur bei Dosen, bei denen die Effekte der Strahlung durch die natürlichen (sporadischen) Todesursachen maskiert sind. Ohne diese Daten ist eine LNT-Beziehung offenkundig.
A.1.2 Studien des Oak Ridge National Laboratory (ORNL) zur Krebsinduktion bei RFM-Mäusen (ORNL-3) (Ullrich und Storer 1979a, b, c)
Diese Studien des Oak Ridge National Laboratory (ORNL) untersuchten spezifisch die Dosis- und Dosisleistungs-Effekte bezüglich der Krebsinzidenz in den Tieren, die von Storer et al. 1979 beschrieben wurden. Die Studien wurden mit einer besseren Standardisierung durchgeführt als einige der früheren Manhattan-Studien; es wurden gut definierte Laborstämme verwendet und in einigen der späteren Studien wurden die Hygiene-Standards (spezifisch keimfreie Tiere) verbessert.
Studienplanung und Durchführung
Es wurden Inzuchtmäuse (RFM) verwendet. Der RFM-Stamm zeigt eine niedrige sporadische Inzidenz für Leukämie, aber er ist sehr sensitiv für strahleninduzierte myeloische und lymphoide Leukämien. Andere häufige Krebsarten in RFM-Mäusen sind Retikulumzellsarkome (57 % in männlichen und 70 % in weiblichen Mäusen) und Lungentumoren (24 % in männlichen und 19 % in weiblichen Tieren).
Bedenken wegen der genetischen Inhomogenität des Stamms und dessen offensichtliche Segregation des Strahlensuszeptibilität-Phänotyps wurden ca. 1970 geäußert (Spalding et al. 1970). Der genetische Status der im ORNL verwendeten RFM/Un-Variante ist unbekannt. Aufgrund des Umfangs der Studie (Einsatz von vielen Tausenden von Mäusen) können genetische Drift und saisonale Variabilitäten nicht ausgeschlossen werden, obwohl die Übereinstimmung der strahleninduzierten Krebsinduktion zwischen den Kohorten, die zu verschiedenen Zeiten exponiert wurden, bemerkenswert gut ist (Ullrich und Storer 1979c).
Die Tiere wurden im Alter von zehn Wochen mit einer Einzeldosis von 137Cs-Gamma-Strahlung (450 mGy/min) behandelt und gehalten, bis sie starben oder erkrankten. Die applizierten Dosen variierten zwischen 100 mGy und 3 Gy. Da Strahlenexposition eine signifikante Lebenszeitverkürzung verursachte, wurde eine mathematische Korrektur durchgeführt, um die Gesamt-Tumorinzidenz in jeder Kohorte unter Berücksichtigung der durch Tod verlorenen Tage potenziellen Risikos anzupassen. Allerdings wurde keine Korrektur für konkurrierende Todesursachen durchgeführt.
Ergebnisse der Studie
Retikulumzellsarkom (follikuläres B-Zell-Lymphom)
Dieser Tumor niedriger Malignität (auch als histiozytisches Lymphom bezeichnet) wird heute als follikuläres B-Zell-Lymphom (FBL) klassifiziert (Morse et al. 2002). In den ORNL-Studien wurde dessen hohe sporadische Inzidenz beschrieben, die 52 % in weiblichen und 42 % in männlichen Tieren betrug. Diese Inzidenz war dennoch niedriger als in anderen Studien, und zwar möglicherweise aufgrund der keimfreien (SPF) Bedingungen, die Anwendung fanden. Strahlenexposition verursachte eine dosisabhängige Abnahme von FBL, vermutlich weil die Tiere an anderen strahleninduzierten Tumoren starben. Das Fehlen einer Strahleninduktion von FBL stimmte nicht mit anderen Studien überein, die FBL als strahleninduzierbaren Tumor beschrieben (Szymańska et al. 2004).Tatsächlich wurde in einer kürzlich veröffentlichten Studie in einem genetisch empfindlichen Mausstamm eine lineare Dosis-Wirkungsbeziehung für die Induktion von B-Zell-Lymphomen beschrieben, allerdings für kleine Tierzahlen und in einem geringen Dosisbereich (0,1 Gy und 3 Gy Gamma-Strahlung) (Iskander et al. 2009). Es könnte sein, dass Strahleneffekte durch die Adjustierung für Alterung und die fehlende Korrektur für konkurrierende Todesursachen maskiert wurden.
Lymphome des Thymus
Es handelt sich um eine bösartige Tumorerkrankung, bei der aggressive leukämische Zellpopulationen den Thymus infiltrieren. Jüngste Untersuchungen wiesen nach, dass diese leukämischen Zellen sowohl von B- als auch T-Zellen abstammen können. In Abbildung 1 von Ullrich und Storer 1979a wurde die Zunahme an Lymphomen des Thymus dargestellt und die Dosis-Wirkungsbeziehung als „komplex“ bezeichnet. Es gibt keine Evidenz für eine quadratische Komponente der Dosis-Wirkungskurve, und es sieht eher aus, als würde sich die Kurve bei Dosen über 500 mGy abflachen.
Myeloische Leukämie
Die sporadische Inzidenz für myeloische Leukämie war in diesem Mausstamm sehr niedrig. Sie war in männlichen Tieren bei Dosen von 500 mGy erhöht und in weiblichen erst bei 1,5 Gy. Die niedrigen Häufigkeiten für myeloische Leukämie, verbunden mit anderen Todesursachen (z. B. thymische Leukämie) sind Faktoren, die die statistische Aussagekraft („Power“) dieser Studie stark beeinträchtigen, um Effekte bei niedrigen Dosen nachzuweisen. Vermutlich war die erhöhte Inzidenz von Lymphomen des Thymus in weiblichen Tieren für den geringen Anstieg an myeloischer Leukämie verantwortlich, denn die Daten wurden nicht für konkurrierende Ursachen korrigiert. Für diesen Tumortyp wurde die Dosis-Wirkungsbeziehung als linear „angemessen beschrieben“. Es gab keine Anzeichen für Aufwärts- oder Abwärtsbiegungen der Kurve.
Solide Tumoren
Da dieser Mausstamm ein hohes Niveau an sporadischen Retikulumzellsarkomen und Lungentumoren zeigt und strahleninduzierte Leukämien sehr häufig auftreten, ist die Eignung dieses Mausmodells zum Nachweis strahleninduzierter solider Tumoren begrenzt auf schnell wachsende Tumoren. Drei Typen solider Tumoren wurden für eine statistische Analyse als ausreichend häufig angesehen. Allerdings wurden auch in diese Analyse konkurrierende Tumoren nicht einbezogen. Die Inzidenz wurde unter Verwendung der Alters-Adjustierung berechnet. Tumoren des Eierstocks, der weiblichen Hypophyse und der männlichen und weiblichen Harderschen Drüse wurden evaluiert. Nur für die Tumoren der weiblichen Harderschen Drüse konnte ein LNT-Modell statistisch signifikant ausgeschlossen werden. Keiner der anderen Tumortypen zeigte eine exponentielle Komponente der Dosis-Wirkungsbeziehung. Hingegen war in der ersten Publikation (Ullrich und Storer 1979b) eine starke Zunahme von Ovarialkrebs bei Dosen von 500 mGy beschrieben worden. Allerdings zeigten die Wiederholungsexperimente in einer weiteren Publikation einen wesentlich geringeren sprunghaften Anstieg (siehe Tabelle II in Ullrich und Storer 1979c).
Diskussion
Das Design der Studie ist angemessen, trotz der Bedenken wegen der unzureichenden genetischen Homogenität. Die Studie hat nicht genügend statistische Aussagekraft, um Effekte unter 100 mGy nachzuweisen. Eine Korrektur für konkurrierende Todesursachen könnte wertvoll für die Interpretation der Daten sein. Die Todesursachen für ca. 50 % der Mäuse der Kontrolle und für 50 bis 80 % der Versuchstiere werden in dieser Studie angegeben. Die Ursachen für den Tod der übrigen Mäuse werden nicht aufgeführt.
Das Fehlen einer modernen immunhistologischen Absicherung der hämatologischen Tumortypen macht viele der Schlussfolgerungen unsicher, da die unterschiedlichen Tumorarten durchaus unterschiedliche Strahlenempfindlichkeiten zeigen könnten. Es gibt keine Hinweise auf eine linear-quadratische Dosis-Wirkungsbeziehung, weder für thymische noch für myeloische Leukämien, sondern beide Tumortypen zeigen Evidenzen für das LNT-Modell.
Die Inzidenz solider Tumoren ist in dem ausgewählten Modellsystem niedrig und eine Abweichung von einer linearen Dosis-Wirkungsbeziehung ist nur für Tumoren der Harderschen Drüse in weiblichen Tieren (einem Tumortyp ohne Entsprechung beim Menschen) nachzuweisen.
A.1.3 Studien des Oak Ridge National Laboratory (ORNL) mit BALB/c-Mäusen (ORNL-4) (Ullrich und Storer 1979c)
Als Ergänzung zu der umfangreicheren Studie mit RFB-Mäusen haben Ullrich und Kollegen Kohorten weiblicher BALB/c-Mäuse mit 137Cs-Gammstrahlung mit einer Rate von 400 mGy/min behandelt. Es wurden akute Dosen von 500 mGy und 2 Gy appliziert. Im Gegensatz zur RFB-Maus entwickelt die BALB/c-Maus wenig sporadische oder strahleninduzierte maligne hämatopoetische Tumoren (ca. 2 %), was eine bessere Analyse der Inzidenz solider Tumoren ermöglicht. Allerdings ist die BALB/c-Maus aufgrund einer Infektion mit dem murinen Mammatumor-Virus (MMTV) höchst anfällig für die Entwicklung von Brusttumoren. Der Stamm hat eine homozygote Defizienz für das kodierende Gen des Enzyms DNA-PKcs (DNA-dependent protein kinase, catalytic subunit), das als Sensor für DNA-Doppelstrangbrüche eine wichtige Rolle für deren Reparatur spielt. Dennoch sollte dies keine Ursache für strahleninduzierte Krebsinduktion sein, da dieser Stamm nicht überempfindlich gegenüber Strahlung ist.
Studienplanung und Durchführung
Die Studienplanung und ihre Durchführung erfolgten wie bei der vorherigen ORNL-Studie mit RFM-Mäusen.
Ergebnisse der Studie
Ovarialkrebs
Sporadische Ovarialkarzinome wurden in nur 5 % der Mäuse beobachtet, aber bei der niedrigsten akuten Strahlendosis von 500 mGy betrug die Inzidenz 66 %, mit einem Anstieg bis auf 72 % nach 2 Gy. Eindeutig zeigte diese Studie genügend Sensitivität und einen nicht-linearen Dosis-Effekt, aber sie erlaubte keine präzise Aussage über die Natur der Dosis-Wirkungsbeziehung.
Brustkrebs
Wenngleich nur Daten für 0,500 mGy und 2 Gy erstellt wurden, zeigte sich eine lineare Dosis-Wirkungsbeziehung, aber die Inzidenzen erhöhten sich nur von 7,6 % auf 10,5 %.
Lungenkrebs
Wie für Brustkrebs stieg die Inzidenz von Lungenkrebs mit der Dosis auf eine Art und Weise an, die als einfache lineare Dosis-Wirkungsbeziehung beschrieben werden konnte.
Diskussion
Die Verwendung der BALB/c-Mäuse hat Vorteile für die Analyse solider Tumoren. Wie bei der Studie mit RFM-Mäusen ist die Interpretation schwierig, da konkurrierende Todesursachen nicht berücksichtigt werden. Allerdings ist bei diesem Maus-Modell die Interpretation weniger fehleranfällig, da FBL als konkurrierender Faktor fehlt.
Sowohl Lungen- als auch Brustkrebs zeigen eine lineare Dosis-Wirkungsbeziehung für Dosen zwischen 500 mG und 2 Gy. Die Anstiege der Kurven unterscheiden sich bei den beiden Tumorarten. Ovarialkrebs stellt eine ungewöhnliche Situation dar, da mehr als 60 % der Mäuse an diesem Krebs bei einer Dosis von nur 500 mGy erkranken. Wie bei der Studie mit der RFM-Maus führen höhere Dosen zu einer nahezu konstanten Inzidenz.
A.1.4 Zweite Studie des Oak Ridge National Laboratory (ORNL) zur akuten Exposition von BALB/c-Mäusen (ORNL-5) (Ullrich 1983)
Als Teil einer RBE22-Studie wurde vom Oak Ridge National Laboratory (ORNL) eine Dosis-Effekt-Studie für 137Cs-Gamma-Strahlung mit BALB/c-Mäusen durchgeführt, die im Prinzip eine Wiederholung der vorherigen ORNL-Studie darstellte (Ullrich und Storer 1979c).
Studienplanung und Durchführung
Obwohl der Umfang der Studie geringer war als der der vorherigen, hatte sie den Vorteil einer besseren Standardisierung der Tierhaltung, wodurch im Experiment die Variabilität durch externe Faktoren reduziert werden konnte. Einzeldosen von Gamma-Strahlen (100 mGy bis 2 Gy) wurden jeweils mit einer Rate von 400 mGy/min appliziert, und die Tiere wurden unter SPF-Bedingungen keimfrei gehalten, wie bereits beschrieben (Ullrich und Storer 1979c). Eine Alters-Adjustierung wurde durchgeführt, jedoch wurden konkurrierende Todesursachen nicht einbezogen. Bemerkenswert ist, dass die sporadische Inzidenz für solide Tumoren vergleichbar ist zu derjenigen aus früheren Studien.
Ergebnisse der Studie
Ovarialkrebs
Wie in der ersten ORNL-Studie nahm die Inzidenz an Ovarialkarzinomen explosionsartig zu; nach nur 500 mGy zeigten mehr als 70 % der Mäuse Tumoren. In dieser Studie verursachte eine niedrigere Dosis von 250 mGy eine Tumorinzidenz von 35 %, während die niedrigste Dosis von 100 mGy keinen Effekt hatte. Diese Dosis-Wirkungsbeziehung erschien einmalig für solide Tumoren, und sie wurde auf eine reaktive Hyperplasie der Ovarialgewebe infolge von Zelltod in der Pfortader-Hypophysen-Gonaden-Achse zurückgeführt (Tennent und Beamer 1986). Ein derartiges Ovarialkarzinom wird in Studien über Dosis-Wirkungsbeziehungen meistens nicht berücksichtigt.
Brustkrebs
Im Großen und Ganzen war die Dosis-Wirkungsbeziehung in dieser Studie linear und vergleichbar zu derjenigen in der früheren Studie. Als einzige Ausnahme trat bei 250 mGy ein einzelner Peak in der Inzidenz von Brusttumoren auf. Die Ursache für diese Abweichung ist unbekannt, aber sie veranlasste die Autoren − in Abweichung von ihren Daten aus der vorherigen Studie − über die Existenz einer nicht-linearen Wirkungsbeziehung zu spekulieren.
Lungenkrebs
Es wurde eine Dosis-Wirkungsbeziehung beobachtet, die nahezu identisch ist mit den Daten, die in der früheren ORNL-Studie gewonnen wurden (Ullrich und Storer 1979c). Die Autoren schlugen vor, dass entweder eine lineare Beziehung (wie in ihrer vorherigen Publikation) oder eine quadratische Beziehung an die Daten angepasst werden könnte. Aus Gründen, die nicht leicht nachvollziehbar sind, haben sie die Schlussfolgerung gezogen, dass auf der Basis einer biophysikalischen Theorie ein linear-quadratisches Modell korrekt sei.
Diskussion
Die Studie repliziert viele Befunde der vorherigen Studie und ist daher sehr wertvoll. Die Dosis-Wirkungsbeziehung für Ovarialkrebs hat eindeutig biologische Ursachen, die sich von denen für andere solide Tumoren unterscheiden. Die Dosis-Wirkungsbeziehungen für Lungen- und Brustkrebs können sowohl mit einer linearen als auch mit einer quadratischen Funktion angepasst werden. Die Entscheidung der Autoren für nicht-lineare Modelle basiert in beiden Fällen nicht auf verlässlichen experimentellen Evidenzen und widerspricht vielmehr ihren vorhergehenden Schlussfolgerungen.
A.1.5 MRC23-Studie über die Induktion von myeloischer Leukämie in CBA/H-Mäusen durch akute Röntgenbestrahlung (MRC-1) (Mole et al. 1983)
Studienplanung und Durchführung
CBA/H-Mäuse wurden mit akuten Einzeldosen von 250kVp-Röntgenstrahlung behandelt, entweder mit 5,5 Gy/min oder 0,55 Gy/min. Zehn verschiedene Dosen lagen zwischen 0,25 Gy und 6 Gy. Die Studie erstreckte sich über acht Jahre, und es wurden neue Tiere in die Studie einbezogen. Spezielle Hygienestandards wurden nicht berücksichtigt. Die Tiere wurden bis zu ihrem Tod oder dem Beginn einer Erkrankung gehalten. Das Auftreten von Hepatosplenomegalie galt als erste Diagnose, und danach wurde eine histologische Analyse durchgeführt, bei der die zelluläre Morphologie als einziges Kriterium für den myeloischen Ursprung der Leukämie diente. Es ist zu bemerken, dass der Stamm keine sporadische AML entwickelte, da von mehr als 800 Kontrollmäusen kein Tier AML zeigte. Konkurrierende Todesursachen wurden protokolliert, aber es erfolgten keine Korrekturen.
Ergebnisse der Studie
Eine maximale AML-Inzidenz von 21 % wurde bei 2,5 Gy gefunden. Bei höheren Dosen nahm die Häufigkeit ab, sodass bei der maximalen Dosis von 6 Gy kein Fall von AML gefunden wurde (Abtötung des Stammzell-Pools?). Die Autoren haben alle vorhandenen Dosen genutzt, um eine komplexe polynomische Kurve anzupassen. Die Festlegung des Verlaufs der Dosis-Wirkungskurve ist offenbar im Vorhinein festgelegt worden, denn die Autoren erklären ihre Auswahl der Kurvenanpassungen auf der Basis einer mathematischen Vorhersage des Mechanismus der Tumorentstehung. Es wurde angenommen, dass die beiden höchsten Datenwerte Artefakte sind (bedingt durch den Verlust von Tieren), was entweder durch die Letalität der verwendeten Dosen von 4,5 Gy und 6 Gy begründet sein könnte oder durch das Auftreten konkurrierender Todesursachen (Lymphome des Thymus wurden von den Autoren erwähnt, aber es wurden keine Daten gezeigt). Allerdings könnten die restlichen Daten genauso gut durch alternative Kurven angepasst werden (wie auch durch ein LNT-Modell).
Diskussion
Der steil abwärts gerichtete Verlauf der Dosis-Wirkungskurve lässt vermuten, dass die Abnahme der AML-Inzidenz möglicherweise auf die letale Wirkung der extrem hohen Dosen oder auf das Auftreten anderer Nicht-AML-Tumoren zurückzuführen ist. Eine Rechtfertigung für das Einschließen der Datenwerte sehr hoher Dosen und für die Annahme einer polynomischen Beziehung wird nicht gegeben. Ein LNT-Modell könnte genauso gut für die restlichen Daten verwendet werden.
A.1.6 JANUS-Studien des Argonne National Laboratory (ANL) zu Tumorinzidenzen (JANUS-1) (Grahn et al. 1992)
Die verschiedenen JANUS-Studien, die Neutronen- und Gamma-Strahlen verglichen, umfassten umfangreiche Arbeiten über Effekte von Einzeldosen von 60Co-Gamma-Strahlung. Die Studien sind in verschiedenen Formaten publiziert worden, aber die Studie von Grahn et al. (1992) ist die umfangreichste für die Bewertung der Dosis-Wirkungsbeziehungen für die Induktion von Tumoren.
Studienplanung und Durchführung
Erwachsene männliche und weibliche B6F1-Mäuse (ein F1-Hybrid zwischen C57Black6 und BALB/c) wurden mit 60Co-Strahlung mit akuten Dosen zwischen 0,9 Gy und 7,88 Gy behandelt. Die Tiere wurden hinsichtlich ihrer Lebensdauer analysiert, und gestorbene oder erkrankte Tiere wurden nach ihrem Tod histopathologisch untersucht. Genetische Drift, Infektionen und Fluktuationen in der Tierhaltung wurden durch das experimentelle Design minimiert – allerdings sind bei einer Studiendauer von 15 Jahren einige Fluktuationen unvermeidlich. Der verwendete F1-Hybridstamm war empfindlich bezüglich des Auftretens sporadischer Lymphome, denen ein sehr hoher Prozentsatz der Tiere (≥ 50 %) zum Opfer fiel. Myeloische Leukämien traten selten auf (2 bis 3 %). Solide Tumoren in unbestrahlten Mäusen waren überwiegend Lungen-, Leber- und Hardersche Drüsen-Tumoren. In weiblichen Tieren waren sporadische Brust- und Ovarialtumoren selten. Es ist herauszustellen, dass sich die Dosen, mit denen männliche und weibliche Mäuse behandelt wurden, unterschieden und dass viele Tumortypen durch unterschiedliche Dosisbereiche induziert wurden.
Ergebnisse der Studie
Die Studie behauptet, dass die Induktion der Tumoren des lymphopoietischen Systems sowie die aller untersuchten soliden Tumoren (Ovar, Leber, Lunge, Hypophyse und Harderscher Drüse) durch eine linear-quadratische Dosis-Wirkungskurve erklärbar seien.
Die Datensätze für jeden Tumortyp in männlichen und weiblichen Tieren wurden in einer unzureichenden Art und Weise präsentiert, die den Vergleich zu anderen Studien nahezu unmöglich macht. Die Evidenz für den Verlauf einer Dosis-Wirkungskurve wurde mittels einer statistischen Auswertung der angepassten Kurve erbracht. Weder die tatsächlichen Werte für die Tumorinzidenzen per Dosis noch die verwendeten Dosen wurden angeführt, und alternative Möglichkeiten der Kurvenanpassung wurden nicht angegeben, d. h. mögliche Abweichungen von der angenommenen linear-quadratischen Anpassung wurden nicht diskutiert.
Diskussion
Die wenig transparente Präsentation der Studie macht eine ausführliche Bewertung der Befunde schwierig. Bemerkenswert ist der Befund, der in Übereinstimmung zu den ORNL-Daten ist, dass sich für alle soliden Tumoren eine lineare Dosis-Wirkungsbeziehung über den analysierten Dosisbereich von Gamma-Strahlung ergibt. Diese Studie sollte mit modernen statistischen Mitteln erneut bewertet werden, damit ein direkter Vergleich mit anderen Studien möglich wird. Gleichwohl, die JANUS/ANL-Studie unterstützt die Schlussfolgerung, dass der DREF = 1 ist.
A.1.7 ENEA-Studie über Kanzerogenese bei niedrigen Dosen (ENEA-1) (Covelli et al. 1988)
Das italienische nationale Forschungszentrum ENEA24 hat eine Studie über die Lebensdauer von F1-Hybriden von C57 x C3H-Mäusen durchgeführt. Diese Tiere zeigten eine hohe sporadische Inzidenz von Lymphomen und Weichteilsarkomen, während strahleninduziert überwiegend Ovarialtumoren auftraten. Lymphome und myeloische Leukämien zeigten keine strahleninduzierte Zunahme.
Studienplanung und Durchführung
Eine akute Exposition mit 250 kV-Röntgenstrahlen wurde lebenslang in ihren Auswirkungen („a lifetime follow-up“) nachverfolgt. Die Studie bezog nur weibliche Tiere der F1-Generation ein. Die Stärken dieser Studie waren die detaillierten histopathologischen Analysen, die Seltenheit von Tumoren der Harderschen Drüsen und die Verwendung niedriger Strahlendosen. Eine ausgeprägte Schwäche der Studie waren die niedrigen Zahl der gefundenen Tumoren und die sehr kleinen Probengrößen pro Gruppe (55 Mäuse bis 100 Mäuse pro Dosis). Die Expositionsdosen lagen zwischen 2,4 Gy und 40 mGy.
Ergebnisse der Studie
Die niedrige Inzidenz der soliden Tumoren wurde nicht überdeckt durch große Änderungen bei den strahleninduzierten hämatopoietischen Tumoren. Solide Tumoren, mit Ausnahme der Ovarialkarzinome, die getrennt behandelt wurden, zeigten eine lineare Dosis-Wirkungsbeziehung. Allerdings räumen die Autoren ein, dass eine linear-quadratische Kurve eine nahezu ebenso gute Anpassung liefern würde. Ovarialkarzinome zeigten eine Dosis-Wirkungskurve, die nahezu identisch zu derjenigen früherer ORNL-Studien ist, mit einem steilen Anstieg über 80 mGy. Bei größeren Dosen wurden sehr geringe Änderungen in der Inzidenz beobachtet.
Diskussion
Es handelt sich um eine kleine, aber detaillierte Studie mit Aussagen für Dosen unter 1 Gy. Die Bestätigung der eindeutig nicht-linearen Dosiswirkung für Ovarialkarzinome ist wertvoll. Daten für andere solide Tumoren können genutzt werden, um eine lineare Dosis-Wirkungsbeziehung entweder zu bestätigen oder zu verwerfen. Eine Wiederholung der Auswertung der Datensätze für niedrigste Dosen bestätigt tatsächlich, dass Effekte von Dosen unter 300 mGy nicht von denen sporadischer Raten zu unterscheiden sind (DiMajo et al. 2003).
A.1.8 Überlebensstudie des SCK-CEN25 für akute Röntgenexposition (SCK-1) (Maisin et al. 1996)
Die Studie wurde konzipiert, um die Effekte von Neutronen- und Photonenstrahlen zu vergleichen. Männliche C57BL-Mäuse wurden für die Studie ausgewählt, obwohl sie nicht identisch zu Stämmen sind, die für andere Bestrahlungsstudien (ORNL) verwendet wurden. Eine etwas niedrigere sporadische Rate solider Tumoren und eine extrem lange Lebenserwartung unter SPF-Bedingungen sind für diesen Mausstamm im Vergleich zu anderen C57-Stämmen charakteristisch.
Studienplanung und Durchführung
Unter SPF-Bedingungen gehaltene männliche, 7 oder 21 Tage alte Mäuse wurden mit Einzeldosen von 250 kVp-Röntgenstrahlen (jeweils 0,5 Gy, 1 Gy oder 3 Gy) behandelt und bis zu ihrem natürlichen Tod beobachtet. Eine histologische Untersuchung der Gewebe wurde durchgeführt, wofür die histologische Standardklassifizierung nach EULEP26 angewendet wurde. Diese Studie erstellte Überlebenskurven nach Kaplan Meier, die für konkurrierende Todesursachen korrigiert wurden. Somit repräsentiert die Studie eine anerkannte hochaktuelle Analysetechnik. Die Probengrößen waren mit 70 bis 85 Mäusen pro Behandlung klein; folglich wurden in der Studie die Inzidenzen aller Tumoren (sowohl als direkte Todesursache als auch als mögliche Ursache für den Tod) für die Bewertung der Dosis-Wirkungsbeziehung zusammengefasst.
Ergebnisse der Studie
Eine Reduktion der Lebenszeit (von 755 Tage auf 593 Tage) wurde bei einer Exposition mit 3 Gy, aber nicht mit 0,5 Gy oder 1 Gy beobachtet. Die Exposition bewirkte eine Zunahme des frühen Todes, aber auch eine Verlängerung der Lebensdauer der Überlebenden. Das führt zu der interessanten Frage nach einer frühen tumorpromovierenden und einer späten tumorunterdrückenden Wirkung von Strahlung. Die Daten sind konsistent mit Änderungen in der Latenzzeit, die durch Tanaka et al. am Institute of Ecological Studies (IES) Rokkasho (Tanaka et al. 2003, Tanaka et al. 2007) für chronische Exposition beschrieben wurden. Die Dosis-Wirkungsbeziehung für die gepoolte Krebsinzidenz ist in dem untersuchten Dosisbereich linear bis zu 3 Gy.
Diskussion
Die Studie verwendet moderne statistische und pathologische Methoden, hat jedoch einen geringen Probenumfang. Bei Einsatz der gepoolten Krebsinzidenzen ergibt sich eine lineare Dosis-Wirkungsbeziehung für alle Krebsarten, und dieses ist ein starker Hinweis auf einen DDREF von 1.
A.2 Studien zum Effekt der Dosisleistung
A.2.1 Die JANUS-Studien (JANUS-2) (Lorenz 1955, Grahn 1994)
Studienplanung und Durchführung
Es handelt sich um komplexe Serien von Studien, die die Lebensdauer als Parameter benutzt und Expositionen mit verschiedenen Dosisleistungen durchgeführt haben. Diese Studien fanden dadurch Beachtung, dass sie die ersten Belege für einen möglichen hormetischen (d. h. lebensverlängernden) Effekt bei chronischen Expositionen mit niedrigen Dosis-Raten erbrachten.
Ergebnisse der Studie
Diese Studien wurden zu späteren Zeiten wegen offensichtlicher Mängel in der Studienplanung und deren Durchführung in Frage gestellt. Eine Darstellung der Ergebnisse ist daher nicht sinnvoll.
Diskussion
Änderungen bei den Kontroll-Tieren, unzureichend kontrolliertes Umfeld und die Unterbringung der Test- und Kontroll-Tiere in unterschiedlichen Gebäuden müssen als Störfaktoren angesehen werden. Diese Studie ist nachträglich als Beleg für Lebensverlängerung durch Strahlung interpretiert worden, aber sie hat keine direkte Relevanz mehr für die Bewertung des DDREF und sollte daher in Zukunft nicht mehr berücksichtigt werden.
A.2.2 Studien des Oak Ridge National Laboratory (ORNL) zur Lebenszeitverkürzung von RFM-Mäusen (ORNL-6) (Storer et al. 1979)
Als Teil der großangelegten Studien des Oak Ridge National Laboratory (ORNL) (siehe oben) wurden die Effekte einer Reihe von Dosen verglichen, die mit unterschiedlichen Dosisleistungen appliziert wurden.
Studienplanung und Durchführung
Die Tiere (männliche und weibliche RFM-Mäuse) wurden im Alter von zehn Wochen einer Langzeit-Behandlung mit 137Cs-Gamma-Strahlendosen zwischen 10 mGy und 4 Gy ausgesetzt, die mit einer Dosisleistung von 450 mGy/min oder von 83 mGy/Tag eingestrahlt wurden. Die Studie bestätigte den Effekt der Bestrahlung auf die Lebenszeitverkürzung, ungeachtet der Todesursache.
Ergebnisse der Studie
Sowohl in männlichen als auch weiblichen RFM-Mäusen stand die Lebenszeitverkürzung in Bezug auf die applizierte kumulative Dosis in einer linearen Dosis-Wirkungsbeziehung, und zwar unabhängig von der ausgewählten Dosisleistung. Die Dosis-Kurven für die verschiedenen Dosisleistungen schienen parallel zu verlaufen, und sie überlagerten sich bis zu kumulativen Dosen von 50 mGy. Die Nicht-Linearität in diesem niedrigen Dosisbereich (mit hohen Unsicherheiten) ist als Beweis für einen DDREF von 2 ausgelegt worden.
Diskussion
Berücksichtigt man die Befunde von anderen Studien mit RFM-Mäusen, dass Lymphome den fast einzigen Tumortyp darstellen, ist die Übertragung des Effekts der Lebenszeitverkürzung auf strahleninduzierte solide Tumoren nicht ratsam. Allerdings deuten die Ergebnisse der Überlebensstudien (unabhängig von der Todesursache) an, dass es keinen Effekt der Dosisleistungen auf die Lebenszeitverkürzung nach Bestrahlung gibt, und dieses bestätigt eindeutig die Existenz eines DDREF von 1.
A.2.3 Studien des Oak Ridge National Laboratory (ORNL) über protrahierte Bestrahlungen von RFB-Mäusen (ORNL-7) (Ullrich und Storer 1979c)
Eine Schlüsselfunktion unter den Tierstudien für das Verständnis von Dosisleistungs-Effekten lieferte die großangelegte Studie des Oak Ridge National Laboratory (ORNL) mit RFM-Mäusen, die protrahierter Gamma-Strahlung ausgesetzt wurden (Ullrich und Storer 1979c). Diese Studie ersetzte eine frühere, wesentlich kleinere Studie, die von Upton (Upton et al. 1970) geleitet wurde und die unter weniger streng kontrollierten Bedingungen durchgeführt worden war. Die Upton-Studie wurde in mehreren Studien interpretiert, wobei sich die Auswahl der Daten und die Strategien der Auswertung unterschieden. Es erscheint nicht sinnvoll, noch mehr Interpretationen zu versuchen (Es ist dabei zu bemerken, dass die männlichen Tiere für die akute Exposition mit Röntgenstrahlen und für die chronische Exposition mit Gamma-Strahlen exponiert wurden) und verwirrende RBE-Effekte einzuführen (vergleiche Upton et al. 1970 mit Ullrich und Storer 1979c).
Studienplanung und Durchführung
Weibliche RFM-Mäuse wurden unter denselben Bedingungen (SPF) exponiert, die für die Dosis-Effekt-Studien von Ullrich und Storer (1979a, b) verwendet wurden. Zusätzlich zu den akuten Bestrahlungen mit 400 mGy/min wurden weitere Tiere der kleinen Dosisleistung von 83 mGy/Tag für unterschiedliche Zeiten ausgesetzt, sodass sie kumulative Dosen von 500 mGy, 1 Gy und 2 Gy erhielten. Wie bei den früheren ORNL-Studien wurden die Daten für Altersabhängigkeit der Inzidenz, aber nicht für konkurrierende Todesursachen korrigiert. Aus völlig unverstandenen Gründen lag die Gesamt-Tumorinzidenz nur knapp über 50 %, und zwar für beide Kohorten mit akuter und chronischer Exposition in gleicher Weise. Die Todesursachen für nahezu die Hälfte der in dieser Studie eingesetzten Tiere wurden nicht erwähnt.
Ergebnisse der Studie
Retikulumzellsarkome/Follikuläre B-Zell-Lymphome (FBL) bei Exposition mit kleinen Dosisleistungen
Wie in der vorherigen Studie (Ullrich und Storer 1979a) reduzierte akute Bestrahlung die Inzidenz von FBL (Ullrich und Storer 1979c). Für die chronisch exponierte Kohorte wurde eine verringerte Inzidenz von FBL bei der höchsten Kumulativdosis von 2 Gy gefunden, was exakt einem Anstieg der Inzidenz von Lymphomen des Thymus entsprach. Die Inzidenz solider Tumoren war zu niedrig, um die Inzidenz der FBL zu beeinflussen.
Lymphome des Thymus bei Exposition mit kleinen Dosisleistungen
In dieser Studie induzierte die Langzeit-Bestrahlung nur bei der höchsten kumulativen Dosis von 2 Gy eine erhöhte Inzidenz von Lymphomen des Thymus. Die Interpretation der Beziehung zwischen Dosisleistung und der Induktion der Lymphome des Thymus weist nach Ansicht der Autoren auf einen exponentiellen Schwellen-Effekt hin.
Myeloische Leukämie bei Exposition mit kleinen Dosisleistungen
Die Inzidenz der myeloischen Leukämie blieb auf demselben Niveau wie bei den unbestrahlten Kontroll-Mäusen, selbst bei der höchsten kumulativen Dosis von 2 Gy. Eine Interpretation eines Dosisleistungs-Effektes ist daher nicht möglich.
Solide Tumoren bei Exposition mit kleinen Dosisleistungen
Die weiblichen RFB-Mäuse, die einer protrahierten Bestrahlung ausgesetzt waren, entwickelten nur wenige solide Tumoren, ausgenommen bei der höchsten kumulativen Dosis von 2 Gy. Die Inzidenzen für Ovarialtumoren schienen einer linearen Dosis-Wirkungsbeziehung mit Schwellenwert zu folgen, während die Tumoren der Harderschen Drüse eine lineare Dosis-Wirkungsbeziehung ohne Schwellenwert zeigten.
Diskussion
Protrahierte Behandlungen mit Gamma-Strahlen von 500 mGy und 1 Gy (Kumulativdosis) sind wirkungslos hinsichtlich der Induktion von Tumoren. Bei der Gesamtdosis von 2 Gy − mit einer Rate von 83 mGy pro Tag appliziert –
werden Lymphome des Thymus induziert, hingegen wird das Auftreten von follikulären B-Zell-Lymphomen (konkurrierende Todesursachen?) unterdrückt. Ovarial-, Lungen- und Mammatumoren treten nur bei der höchsten kumulativen Dosis von 2 Gy auf. Diese Studie liefert Belege dafür, dass eine chronisch applizierte Dosis ein viel niedrigeres Potenzial der Krebsinduktion hat als die gleich hohe Dosis, die akut appliziert wird.
A.2.4 Studien des Oak Ridge National Laboratory (ORNL) über protrahierte Bestrahlungen von BALB/c-Mäusen (ORNL-8) (Ullrich und Storer 1979c)
Das ORNL führte diese Studie mit einer geringen Anzahl von BALB/c-Mäusen durch und folgte dabei dem Studienaufbau der RFM-Mausstudie (Ullrich und Storer 1979a, b). Die Vorteile des BALB/c-Modells für die Analyse solider Tumoren wurden ebenso wie das Design der Studie oben (siehe Anhang A.1.2, A.1.3) bereits dargestellt.
Ovarialkrebs
Die Langzeit-Behandlung mit einer kumulativen Dosis von 1 Gy induzierte Ovarialtumoren, und zwar mit einer linearen Dosis-Wirkungsbeziehung oberhalb der niedrigsten kumulativen Dosis von 500 mGy.
Brustkrebs
Die Inzidenz der Mamma-Tumoren nahm ebenfalls bei einer Langzeit-Behandlung zu, und zwar nach Ansicht der Autoren mit einer linearen Dosis-Wirkungsbeziehung. Die Anstiege der Kurven für chronische und akute Expositionen unterschieden sich.
Lungenkrebs
Der dosisabhängige Anstieg der Inzidenz der Lungentumoren war eindeutig linear für die kumulativen Langzeit-Expositionen. Die Anstiege der Kurven für chronische und akute Exposition unterschieden sich.
Diskussion
Diese Studie über die Effekte von Dosisleistungen ist begrenzt auf die relativ hohe Dosisleistung von 83 mGy/Tag, und die kleinste kumulative Dosis beträgt 500 mGy. Anders als in der Studie mit der RFM-Maus vermittelt die niedrige sporadische Krebsrate mehr Zutrauen in die Interpretation der induzierten Raten solider Tumoren. Für alle drei in der Studie analysierten Arten von soliden Tumoren gibt es Belege für eine lineare Beziehung zwischen der kumulativen Dosis und der Tumorinzidenz, wenn protrahierte Bestrahlungen durchgeführt werden.
Die Studie belegt überzeugend, dass die Tumorinzidenz bei einer protrahierten Exposition geringer ist, wenn deren kumulierte Dosis mit einer akut applizierten Dosis derselben Größe verglichen wird. Tatsächlich ist die Zahl der Lungen- und Mammatumoren nur dann signifikant erhöht, wenn die kumulative Dosis 1 Gy übersteigt.
A.2.5 JANUS-Studien des Argonne National Laboratory (ANL) zum Einfluss der Dosisrate auf die Tumorinzidenz (JANUS-3) (Grahn et al. 1992)
Die JANUS-Studie, in der die Wirkung von Neutronen- und Gamma-Strahlung verglichen wurde, enthielt umfangreiche Arbeiten über Dosisleistungs-Effekte für die Induktion von Tumoren bei Langzeit-Bestrahlung mit 60Co-Gamma-Strahlung. Die Übersicht von Grahn et al. (1992) bemüht sich um die Darstellung einer kohärenten Gesamtsicht für die sehr variablen und fragmentarischen experimentellen Protokolle, die für die unterschiedlichen Teile des JANUS-Projekts ausgewählt wurden.
Studienplanung und Durchführung
B6CF1-Mäuse wurden mit 60Co-Gamma-Strahlung nach mehreren unterschiedlichen Versuchsprotokollen für protrahierte Bestrahlungen mit unterschiedlichen kumulativen Dosen behandelt. Von den 20 in die Experimente einbezogenen Gruppen von Mäusen erhielten nur vier Gruppen dieselben kumulativen Dosen, was Vergleiche nahezu unmöglich macht. Die Fraktionierungsprotokolle sahen 24 Einzelexpositionen vor, die über 24 Wochen oder 60 Wochen verteilt waren, oder fünf Expositionen pro Woche, die über 23 Wochen oder 59 Wochen durchgeführt wurden. Die Gesamtdosen reichten von 0,225 Gy bis 24,6 Gy.
Ergebnisse
Diese Studien wurden zu späteren Zeiten wegen offensichtlicher Mängel in der Studienplanung und deren Durchführung in Frage gestellt. Eine Darstellung der Ergebnisse ist daher nicht sinnvoll (siehe A.2.1).
Diskussion
Die Probleme mit der Art der Präsentation der Daten wurden bereits für die JANUS/ANL-Studie über die Wirkung akuter Strahlendosen (siehe Anhang A.1.6) diskutiert. Aus denselben Gründen kann für die protrahierten Bestrahlungen mit Gamma-Strahlen das Postulat einer Nicht-Linearität durch die publizierten Daten nicht untermauert werden.
A.2.6 MRC-Studie über myeloische Leukämie in der CBA/H-Maus (MRC-2) (Mole und Mayor 1983)
Die CBA-Maus hat die einzigartige Neigung, myeloische Leukämie infolge Exposition mit externer Strahlung unterschiedlicher Qualitäten zu entwickeln. Der verwendete Stamm ist ein Harwell-Abkömmling der CBA-Maus, von dem man annimmt, dass er sich von anderen CBA-Stämmen, wie z. B. von der CBA/Ca-Maus, genetisch unterscheidet. Männliche Tiere haben eine sehr kurze Lebensspanne, während weibliche Tiere langlebig sind. Die sporadischen Tumorraten und -arten unterscheiden sich zwischen den Geschlechtern erheblich.
Studienplanung und Durchführung
Protrahierte Expositionen mit 250 kVp-Röntgenstrahlung mit kumulativen Dosen zwischen 1,5 Gy und 4,5 Gy wurden entweder als protrahierte Dosis mit kleinen Dosisleistungen (44 µGy/min bis 110 µGy/min) oder als fraktionierte Dosis von insgesamt 5 Gy (20 x 0,25 Gy Fraktionen täglich, für vier bis fünf Tage) appliziert. Myeloische Leukämie als Endpunkt wurde nach dem Tod oder der Tötung erkrankter Tiere histologisch nachgewiesen. Korrekturen für konkurrierende Ursachen wurden nicht ausdrücklich erwähnt.
Ergebnisse der Studie
Die Studie erbrachte keinen Beleg für einen DDREF-Effekt, da jedes Dosierungsschema vergleichbare Tumorinzidenzen lieferte, und zwar ohne Einfluss der Dosisleistung oder der kumulativen Dosis. Das Fehlen einer Dosisabhängigkeit der AML-Inzidenz in dieser Studie stand im Widerspruch zu den Beobachtungen von Mole und Major (1983), die sie nach Behandlung einer akuten Einzeldosis von Röntgenstrahlen publizierten.
Diskussion
Andere Autoren haben vorgeschlagen, dass ein DDREF-Wert für den Datensatz von Mole und Major (1983), der von akut bestrahlten Tieren stammt, berechnet werden kann. Dies ist offensichtlich jedoch unbegründet, da es keinen Beleg dafür gibt, dass die beiden Experimente gleichzeitig durchgeführt wurden. Mehr noch, das Ausbleiben einer Dosis-Wirkungsbeziehung für die AML-Induktion ist unerwartet und weist auf experimentelle Probleme hin.
A.2.7 Lebenszeit-Studie der Japanischen „Electrical Power Association“ Tokyo (JEPA-1) (Ina und Sakai 2004, 2005)
Die Evidenzen dieser Studie werden selten, wenn überhaupt, bei Bewertungen der Effekte von Dosis und Dosisleistung zitiert. Ein Grund ist vermutlich der, dass die Studie nahezu zur selben Zeit vorgestellt wurde wie die ähnliche Studie von Rokkasho (siehe Anhang A.2.8), die entgegengesetzte Effekte berichtete. Dennoch verdient die Studie von Sakai und seinen Mitautoren Beachtung.
Studienplanung und Durchführung
Es handelt sich um eine Lebenszeit-Studie von kleinem Umfang, in der die Tiere einer kontinuierlichen Bestrahlung mit einer kleinen Dosisleistung aus einer 137Cäsium-Quelle behandelt wurden. Die Kontroll-Tiere wurden in einem abgeschirmten Bereich der Expositionskammer gehalten. Die Lebenszeit wurde als Studienendpunkt festgestellt. In dieser Studie wurden MRL-lpr/lpr-Mäuse verwendet, die einen genetisch bedingten Defekt der Immunkompetenz aufweisen.
Ergebnisse der Studie
Eine geringe aber signifikante Verlängerung der Lebenszeit der chronisch mit kleiner Dosisleistung bestrahlten Mäuse wurde beobachtet. Die Todesursachen waren wie bei den Kontroll-Tieren vorwiegend Leukämien und Lymphome.
Diskussion
Diese Studie stimmt grundsätzlich mit der ursprünglichen JANUS-Studie von Lorenz (1955) überein. Sie zeigt eine verlängerte Lebenszeit für Mäuse, welche niedrigen kumulativen Dosen ausgesetzt und die chronisch mit einer kleinen Dosisleistung appliziert wurden. Als Begründung ist eine verbesserte Immunabwehr gegen Infektionen für die Ergebnisse beider Studien von Ina und Sakai vorgeschlagen worden, obwohl sie unter ziemlich unterschiedlichen Umweltbedingungen durchgeführt wurden. Sowohl die Befunde von Ina und Sakai als auch vom Institute of Ecological Studies (IES) Rokkasho (siehe Anhang A.2.8) legen nahe, dass chronische niedrige Dosen zu einem erhöhten Körpergewicht der exponierten Mäuse führen, und zwar durch Modulation des endokrinen Systems zur Glukose-Regulation. Da das erhöhte Körpergewicht eher ein erhöhtes Krebsrisko für Nager darstellt, kann dies vermutlich keine plausible Erklärung der Effekte sein, die von der JANUS- und auch der Sakai-Studie beschrieben worden sind. Diese Studie illustriert die Komplexheit der Reaktionen auf kleine Dosisleistungen.
A.2.8 Lebenszeit-Studien des Institute of Ecological Studies Rokkasho (IES-1) (Tanaka et al. 2003, Tanaka et al. 2007)
Studienplanung und Durchführung
Unter SPF-Bedingungen wurden niedrige Dosen chronisch für die gesamte Lebensdauer appliziert, wobei die Kontroll-Tiere unter identischen Bedingungen gehalten wurden. Weibliche B6CF3F1-Mäuse wurden mit zwei verschiedenen Dosisleistungen (0,015 mGy/min und 0,00076 mGy/min) mit 137Cs-Strahlung behandelt.
Ergebnisse der Studie
In der ersten Auswertung (Tanaka et al. 2003) wurde eine Lebenszeitverkürzung berichtet; in der späteren Auswertung (Tanaka et al. 2007) gab es keine Evidenz für eine generelle Zunahme der Inzidenz von Malignität in den exponierten Mäusen. Die Lebenszeitverkürzung wurde lediglich auf ein früheres Auftreten von Lymphomen und Weichteilsarkomen zurückgeführt.
Diskussion
Es handelt sich um eine gut geplante und sorgfältig durchgeführte Studie, die ein weiteres Beispiel für eine Lebenszeitverkürzung durch chronische Exposition mit niedrigen Dosen liefert. Im Gegensatz zu anderen Studien wurden die Effekte der Lebenszeitverkürzung durch chronische Bestrahlung mit kleinen Dosisleistungen jedoch für eine Verkürzung der Latenzperiode gehalten. Dies lässt vermuten, dass es eine vorgeprägte, genetisch determinierte Empfindlichkeit des Mausstamms gibt, bei dem die spezifischen Tumortypen gefunden werden. Strahlung würde das
Auftreten von Malignität durch einen „zweiten Treffer“ beschleunigen. Diese Studien über kleine Dosisleistungen erbringen keine Belege für oder gegen einen DDREF, der bei Exposition mit sehr kleinen Dosisleistungen berücksichtigt werden müsste. Ähnliche Ergebnisse finden sich in Studien, die von Courtade et al. (2002) durchgeführt wurden.
Tabelle A.1: Studien zum Effekt der Dosis
| Studie | Versuchstiere | Tierhaltung | Bestrahlung | Datenkorrektur | Studientyp | Schlussfolgerungen der Studie |
Ref |
|---|---|---|---|---|---|---|---|
| ORNL-1 (DEF) |
RFM-Mäuse | SPF | 137Cs-Gammastrahlung, akute Einzeldosis: 100 mGy – 3 Gy |
Adjustiert für Alter |
Lebenszeitverkürzung | LNT: 500 mGy – 3 Gy; unter 500 mGy: nicht signifikant abweichend von nicht-exponierten Tieren |
(1) |
| ORNL-2 (DEF) |
BALB/c-Mäuse | SPF | 137Cs-Gammastrahlung, akute Einzeldosis: 100 mGy – 3 Gy |
Adjustiert für Alter |
Lebenszeitverkürzung | LNT: 500 mGy – 3 Gy; unter 500 mGy: nicht signifikant abweichend von nicht-exponierten Tieren |
(1) |
| ORNL 3 (DEF) |
RFM-Mäuse | SPF | 137Cs-Gammastrahlung, akute Einzeldosis: 100 mGy – 3 Gy |
Adjustiert für Alter, nicht adjustiert für konkurrierende Todesursachen |
Tumorinzidenz | Keine Sensitivität unter 500 mGy; Tumoren der Harderschen Drüse zeigen einen linear-quadratischen Dosiseffekt. Hämatologische Malignome zeigen keine Evidenz für linear-quadratischen Dosiseffekt | (2, 3, 4) |
| ORNL 4 (DEF) |
BALB/c-Mäuse | SPF | 137Cs-Gammastrahlung, akute Einzeldosis: 500 mGy und 2 Gy |
Adjustiert für Alter, nicht adjustiert für konkurrierende Todesursachen |
Tumorinzidenz | Ovarkarzinome zeigen einen nicht-linearen Dosis-Wirkungseffekt mit Schwelle; im Widerspruch dazu zeigen Lungen- und Brustkrebs eine LNT-Beziehung |
(4) |
| ORNL-5 (DEF) |
BALB/c-Mäuse | SPF | 137Cs-Gammastrahlung, akute Einzeldosis: 100 mGy – 2 Gy |
Adjustiert für Alter, nicht adjustiert für konkurrierende Todesursachen |
Tumorinzidenz | Daten für Lungen- und Brustkrebs können sowohl an eine lineare als auch linear-quadratische Funktion angepasst werden. Autoren entscheiden sich für nicht-lineare Modelle | (5) |
| MRC-1 (DEF) |
CBA/H-Mäuse | nicht SPF | 250kVp-Röntgenstrahlung, akute Einzeldosis: 0,25 Gy – 6 Gy |
Kein Hygiene-Status, nicht adjustiert für konkurrierende Todesursachen | AML- Inzidenz |
Polynomische Kurvenanpassung für Leukämie, andere Datenanpassungen genauso anwendbar | (6) |
| JANUS-1 (DEF) |
B6F1-Mäuse | 60Co-Gammastrahlung, akute Dosen: 0,9 Gy – 7,88 Gy |
Nicht adjustiert für Todesursachen | Tod, multiple Tumortypen bei Sektion | Induktion der Tumoren des lymphopoietischen Systems sowie die aller untersuchten soliden Tumoren (Ovar, Leber, Lunge, Hypophyse und Harderscher Drüse) durch eine linear-quadratische Dosis-Wirkungskurve erklärbar |
(7) | |
| ENEA-1 (DEF) |
BC3F1-Mäuse | nicht SPF | 250kV-Röntgenstrahlung, akute Einzeldosis: 40 mGy – 4 Gy |
Nicht adjustiert für konkurrierende Todesursachen | Tod („Life-time follow-up“) mit Histopathologie | Keine Evidenz für Abweichung von LNT (außer für Ovarialkrebs) |
(8) |
| SCK-1 (DEF) |
C57B6-Mäuse | SPF | 250kVp-Röntgenstrahlung, akute Einzeldosis: 0,5 Gy, 1 Gy oder 3 Gy |
Kaplan Maier-Überlebenskurven, korrigiert für konkurrierende Todesursachen | Tod und Histopathologie | Für gepoolte Krebsinzidenz ergibt sich eine lineare Dosis-Wirkungsbeziehung |
(9) |
Tabelle A.2: Studien zum Effekt der Dosisleistung
| Studie | Versuchstiere | Tierhaltung | Bestrahlung | Datenkorrektur | Studientyp | Schlussfolgerung der Studie | Ref |
|---|---|---|---|---|---|---|---|
| JANUS-2 (DREF) |
B6F1-Mäuse | nicht SPF | 137Cs-Gammastrahlung, Expositionen mit verschiedenen Dosisleistungen |
keine | Lebensdauer | Diese Studien sind nicht auswertbar | (7, 10) |
| ORNL-6 (DREF) |
RFM-Mäuse | nicht SPF | 137Cs-Gammastrahlung, Bereich für Dosis und Dosisleistungen: 10 mGy – 4 Gy, mit 450 mGy/min oder 83 mGy/Tag bestrahlt |
keine | Lebensdauer ohne Berücksichtigung der Tumorart | Kein Hinweis für einen Dosisleistungs-Effekt nur bei niedrigsten Dosen mit größeren
Unsicherheiten. Daten passen auch zu einem LNT-Modell |
(1) |
| ORNL-7 (DREF) |
RFM-Mäuse | SPF | 137Cs-Gammastrahlung, kumulative Dosen von 0,5 Gy, 1 Gy und 2 Gy mit 83 mGy/Tag |
Korrigiert für Alter nicht aber konkurrierende Todesursachen |
Lebensdauer | Induktion von Tumoren nur signifikant erhöht, wenn die kumulative Dosis 1 Gy übersteigt;
Ovarial-, Lungen- und Mammatumoren treten nur bei der höchsten kumulativen Dosis von 2 Gy auf |
(4) |
| ORNL-8 (DREF) |
BALB/c-Mäuse | SPF | 137Cs-Gammastrahlung, kumulative Dosen von 0,5 Gy, 1 Gy und 2 Gy mit 83 mGy/Tag |
Korrigiert für Alter nicht aber konkurrierende Todesursachen |
Lebensdauer | Dosisleistungs-Effekt für solide Tumoren zu beobachten, wenn die kumulative Dosis 1 Gy übersteigt | (4) |
| JANUS-3 (DREF) |
B6CF1-Mäuse | 137Cs-Gammastrahlung, fraktionierte Dosen von 0,225 Gy – 24,6 Gy appliziert über 24 Wochen oder 60 Wochen |
keine | Lebensdauer | Keine Evidenz für Effekt der Dosisleistung | (10) | |
| MRC-2 (DREF) |
CBA-Mäuse | nicht SPF | 250kVp-Röntgenstrahlung kumulative Dosis: 1,5 Gy – 4,5 Gy, entweder als protrahierte Dosis: 44 µGy/min bis 110 µGy/min oder als fraktionierte Dosis von 5 Gy (20 x 0,25 Gy-Fraktionen täglich, für 4 – 5 Tage) |
Kein Hygiene-Status, nicht adjustiert für konkurrierende Todesursachen | Lebensdauer: nur AML- Inzidenzrate |
Keine Evidenz für einen DREF | (6) |
| JEPA-1 (DREF) |
MRL lpr/lpr-Mäuse (mit verminderter Immunkompetenz) | SPF | 137Cs-Gammastrahlung, entweder 1,2 mGy/h oder 0,35 mGy/h für 23 h pro Woche über 5 Wochen oder gesamte Lebenszeit |
Kaplan Maier-Überlebenskurven | Suppression der Autoimmunkrankheit durch Bestrahlung | Lebenszeit verlängernder Effekt durch chronische Strahlenexposition, aber wahrscheinlich wegen protektiver Wirkung der Strahlung auf die Immunschwäche | (11, 12) |
| IES-1 (DREF) |
B6CF3F1-Mäuse | SPF | 137Cs-Gammastrahlung, chronische Exposition entweder 0,015 mGy/min oder 0,00076 mGy/min |
Kaplan Maier-Überlebenskurven | Lebenszeitverkürzung | Zunehmende Tumorinzidenz entsprechend chronischer Exposition | (13, 14) |
1) Storer et al. 1979. 2) Ullrich und Storer 1979a. 3) Ullrich und Storer 1979b. 4) Ullrich und Storer 1979c. 5) Ullrich 1983. 6) Mole et al. 1983. 7) Grahn et al. 1992. 8) Covelli et al. 1988. 9) Maisin et al. 1996. 10) Lorenz 1955, 11) Ina und Sakai 2004. 12) Ina und Sakai 2005. 13) Tanaka et al. 2003. 14) Tanaka et al. 2007.
- DEF:
-
Dose Effectiveness Factor
- DREF:
-
Dose-Rate Effectiveness Factor
- ENEA:
-
Ente per le Nuove Tecnologie, l’Energiea e l’Ambiente (dt: italienische Nationalagentur für Neue Technologien, Energie und nachhaltige wirtschaftliche Entwicklung)
- IES:
-
Institute of Ecological Studies, Rokkasho (Japan)
- JANUS:
-
Forschungsreaktor beim Argonne National Laboratory (USA)
- JEPA:
-
Japanese Electrical Power Association, Tokyo
- MRC:
-
Medical Research Council (UK)
- ORNL:
-
Oak Ridge National Laboratory (USA)
- SCK:
-
Studienzentrum für Kernenergie (niederländisch Studiecentrum voor Kernenergie/französisch Centre d'Étude de l'énergie Nucléaire, Abk. SCK/CEN), Kernforschungszentrum in Mol (Belgien)
Literatur
| Courtade et al. 2002 | Courtade M, Billotet C, Gasset G, Caratero A, Charlet JP, Pipy B, Caratero C. Life span, cancer and non-cancer diseases in mouse exposed to a continuous very low dose of γ-irradiation. Int J Radiation Biology. 2002;78:845-855 |
| Covelli et al. 1988 | Covelli V, Coppola M, Di Majo V, Rebessi S, Bassani B. Tumor induction and life shortening in BC3F1 female mice at low doses of fast neutrons and x rays. Radiat Res. 1988;113:362-374 |
| Di Majo et al. 2003 | Di Majo V, Rebessi S, Pazzaglia S, Saran A, Covelli V. Carcinogenesis in laboratory mice after low doses of ionizing radiation. Radiat Res. 2003;159(1):102-108 |
| Grahn 1994 | Grahn D. Report ANL-94/26: Studies of Acute and Chronic Radiation Injury at the Biological and Medical Research Division, Argonne National Laboratory, 1953-1970: Description of individual studies, data files, codes, and summaries of significant findings. 1994 |
| Grahn et al. 1992 | Grahn D, Lombard LS, Carnes BA. The comparative tumorigenic effects of fission neutrons and cobalt-60 gamma rays in the B6CF1 mouse. Radiat Res. 1992;129:19-36 |
| Ina und Sakai 2004 | Ina Y and Sakai K. Prolongation of life span assocaited with immunological modification by chronic low dose rate irradiation in MRL-lpr/lpr mice. Radiat Res. 2004;161:168-173 |
| Ina und Sakai 2005 | Ina Y and Sakai K. Further Study of Prolongation of Life Span Associated with Immunological Modification by Chronic Low-Dose-Rate Irradiation in MRL-lpr/lpr Mice: Effects of Whole-Life Irradiation. Radiation Research. 2005;163(4):418-423 doi: http://dx.doi.org/10.1667/RR3316 |
| Iskander et al. 2009 | Iskander K, Barrios RJ, Jaiswal AK. NRH: Quinone Oxidoreductase 2-Deficient Mice Are Highly Susceptible to Radiation-Induced B-Cell Lymphomas. Clin Cancer Res. 2009;15:1534-1542 |
| Lorenz 1955 | Lorenz E, Hollcroft JW, Miller E, Congdon CC, Schweisthal R. Long-term effects of acute and chronic irradiation in mice. I. Survival and tumor incidence following chronic irradiation of 0.11 R per day. Journal of the National Cancer Institute. 1955;15:1049-1058 |
| Maisin et al. 1996 | Maisin JR, Gerber GB, Vankerkom J, Wambersie A. Survival and diseases of C57BL mice exposed to X rays or 3.1 MeV neutrons at an age of 7 or 21 days. Radiat Res. 1996;146:453-460 |
| Mole et al. 1983 | Mole RH, Papworth DG, Corp MJ. The dose-response for x-ray induction of myeloid leukaemia in male CBA/H mice. Br J Cancer. 1983;247:285-291 |
| Mole und Major 1983 | Mole RH and Major IR. Myeloid leukaemia frequency after protracted exposure to ionizing radiation: experimental confirmation of the flat dose-response found in ankylosing spondylitis after a single treatment course with X-rays. Leuk Res. 1983;7(2):295-300 |
| Morse et al. 2002 | Morse III HC, Anver MR, Fredrickson TN, Haines DC, Harris AW, Harris NL, Jaffe ES, Kogan SC, MacLennan ICM, Pattengale PK, Ward JM. Bethesda proposals for classification of lymphoid neoplasms in mice. Blood. 2002;100:246-258 |
| Spalding et al. 1970 | Spalding JF. Popp DM, Popp R. A genetic effect on radiation sensitivity consistent with a single gene locus hypothesis. Radiat Res. 1970;44:670-673 |
| Storer et al. 1979 | Storer JB, Serrano LJ, Darden EB Jr, Jernigan MC, Ullrich RL. Life shortening in RFM and BALB/c mice as a function of radiation quality, dose, and dose rate. Radiat Res. 1979;78:122-61 |
| Szymańska et al. 2004 | Szymańska H, Piskorowska J, Krysiak E, Skurzak H, Czarnomska A, Demant P. Diagnosis and classification of spontaneously developed and radiation-induced murine haematopoietic neoplasms. The murine models for the research on the human haematopoietic neoplasms. Radiol Oncol. 2004;38(3):217-25 |
| Tanaka et al. 2003 | Tanaka S, Tanaka IB 3rd, Sasagawa S, Ichinohe K, Takabatake T, Matsushita S, Matsumoto T, Otsu H, Sato F. No lengthening of life span in mice continuously exposed to gamma rays at very low doses. Radiat Res. 2003;160:376-9 |
| Tanaka et al. 2007 | Tanaka IB 3rd, Tanaka S, Ichinohe K, Matsushita S, Matsumoto T, Otsu H, Oghiso Y, Sato F. Cause of death and neoplasia in mice continuously exposed to very low dose rates of gamma rays. Radiat Res. 2007;167:417-37 |
| Tennent und Beamer 1986 | Tennent BJ und Beamer WG. Ovarian tumours not induced by irradiation and gonadotropins in hypogonadal mice. Biol Reprod. 1986;34:751-760 |
| Ullrich 1983 | Ullrich RL. Tumor induction in BALB/c female mice after fission neutron or gamma irradiation. Radiat Res. 1983;93:506-515 |
| Ullrich et al. 1987 | Ullrich RL, Jernigan MC, Satterfield LC, Bowles ND. Radiation carcinogenesis: time-dose relationships. Radiat Res. 1987;111(1):179-184 |
| Ullrich und Storer 1979a | Ullrich RL und Storer JB. Influence of gamma irradiation on the development of neoplastic disease in mice. I. Reticuloendothelial tumours. Radiat Res. 1979;80:303-316 |
| Ullrich und Storer 1979b | Ullrich RL und Storer JB. Influence of gamma irradiation on the development of neoplastic disease in mice. II. Solid tumours. Radiat Res. 1979;80:317-324 |
| Ullrich und Storer 1979c | Ullrich RL und Storer JB. Influence of gamma irradiation on the development of neoplastic disease in mice. III. Dose-rate effects. Radiat Res. 1979;80:325-342 |
| Upton et al. 1970 | Upton AC, Randolph ML, Conklin JW, Kastenbaum MA, Slater M, Melville GS Jr, Conte FP, Sproul JA Jr. Late effects of fast neutrons and gamma rays in mice as influenced by the dose rate of irradiation: Induction of neoplasia. Radiat Res. 1970;41:467-491 |
Anhang B zu Kapitel 4 „Strahlenepidemiologische Studien“
Epidemiologische Studien im Hinblick auf das Risiko strahleninduzierter solider Tumoren – Bedeutung für den DDREF
B.1 Einleitung
Im Folgenden wird eine Reihe von epidemiologischen Studien beschrieben und bewertet, bei denen die Mortalität und Inzidenz von soliden Tumoren nach Exposition mit niedrigen Dosen und kleinen Dosisleistungen ionisierender Strahlung am Menschen untersucht wurde. Ausgangspunkt war dabei die Meta-Analyse von Jacob und Mitarbeitern, die im Jahr 2009 veröffentlicht wurde und in der auf der Basis einer systematischen Literaturrecherche eine gemeinsame Auswertung zu allen bis zum Jahr 2009 veröffentlichten relevanten Studien durchgeführt wurde. Die von Jacob und Mitarbeitern verwendeten Studien werden weiter unten im Einzelnen näher beschrieben. Dabei wurde der Schwerpunkt auf solide Tumoren als Gruppe gelegt, einzelne Tumorarten sowie Leukämie werden nicht diskutiert.
Zusätzlich zu diesen Studien werden weitere Arbeiten beschrieben. Dies betrifft unter anderem die Studie von Howe et al. 2004, die die erste Analyse zur Mortalität von Beschäftigten in der US-Nuklearindustrie beschreibt. Die Studie von Zablotska et al. 2004 befasst sich mit der ersten Analyse zur Mortalität aller Beschäftigten in der Nuklearindustrie Kanadas, die im kanadischen Dosisregister registriert sind, wobei auch eine neue Analyse dieser Daten diskutiert wird (Zablotska et al. 2012). Beide Kohorten waren bereits Teil der 15-Länder-Studie (Cardis et al. 2005).
Falls nach dem Jahr 2009, dem Erscheinungsjahr der Publikation von Jacob und Mitautoren, aktuellere Studienergebnisse zu denselben Kohorten veröffentlicht wurden, werden diese an Stelle der in Jacob et al. verwendeten Studien diskutiert und in die Bewertung einbezogen. Dies betrifft Studien zu den Beschäftigten der Firma Rocketdyne in den USA (Boice et al. 2011), der französischen Atomenergiebehörde CEA und der Firma AREVA in Frankreich (Metz-Flamant et al. 2011), der Firma Electricité de France in Frankreich (Laurent et al. 2010) sowie eine Studie zu den Aufräumarbeitern von Tschernobyl (Ivanov et al. 2009).
Darüber hinaus werden einige neuere Studien an Kohorten beschrieben, die nach Erscheinen der Arbeit von Jacob et al. veröffentlicht wurden. Dazu zählen die Arbeit von Akiba und Mizuno (2012) an den Beschäftigten in der japanischen Nuklearindustrie, die von Nair et al. (2009) an den Bewohnern von Kerala in Indien sowie die von Tao et al. (2012) an den Bewohnern der Provinz Guangdong in China.
Schließlich wurden für diese Stellungnahme zwei Meta-Analysen betrachtet, bei denen nur einige der hier beschriebenen Einzelstudien berücksichtigt wurden (Akiba und Mizuno 2012, Ogata 2011).
Alle im Anhang B aufgeführten Studien sind in Tabelle B.1 zusammengefasst.
Tabelle B.1: Grundlegende Daten der im Anhang B diskutierten Studien; die Einheit der Dosis ist entsprechend der Originalliteratur angegeben (entweder Gy oder Sv); numerisch sind dadurch für die mittlere kumulierte Dosis und das zusätzliche relative Risiko (ERR) pro Dosis keine wesentlichen Unterschiede zu erwarten, da in der überwiegenden Zahl der Fälle die Exposition durch Strahlung mit niedrigem LET verursacht wurde.
| Kohorte/Land | Follow-Up- Zeitraum |
Personenjahre | Anzahl solider Tumoren (Mortalität oder Inzidenz) |
Mittlere kumulative Dosis |
ERR pro Dosis | Referenz |
|---|---|---|---|---|---|---|
| Hohe Dosisleistung (Mortalität) | ||||||
| Atombombenüberlebende, Japan | 1950 – 2003 | 3,3 x 106 | 10 929 | – | 0,42 (95 %-KI: 0,32 – 0,53) Gy–1 |
Ozasa et al. 2012 |
| Meta-Analysen – Kleine Dosisleistung (Mortalität) | ||||||
| Nuklearindustrie, weltweit | – | – | – | 0,14 (95 %-KI: –0,12 – 0,41) Sv–1 |
Akiba und Mizuno 2012 | |
| Diverse Kohorten, weltweit | – | – | – | – | – | Ogata 2011 |
| Diverse Kohorten, weltweit | – | – | – | – | 1,21 (90 %-KI: 0,51 – 1,90) Gy–1 |
Jacob et al. 2009 |
| Nuklearindustrie, 14 Länder weltweit | 1944 – 2000 | 5,2 x 106 | 6 514 | 19,4 mSv | 0,58 (95 %-KI: –0,22 – 1,55) Sv–1 |
Cardis et al. 2007 |
| Einzelstudien – Kleine Dosisleistung (Mortalität) | ||||||
| Erhöhte Hintergrundstrahlung, China | 1992 – 1997 | 7,37 x 105 | 941 | 81,7 – 88,5 mGyd | 0,19 (95 %-KI: –1,87 – 3,04) Gy–1 |
Tao et al. 2012 |
| Nuklearindustrie, Japan | 1991 – 2002 | 1,4 x 106 | 1 949 | 12,2 mSv | 0,20 (95 %-KI: –1,42 – 2,09)b Sv–1 |
Akiba und Mizuno 2012 |
| Rocketdyne, USA | 1948 – 2008 | 1,97 x 106 | 651e | 13,5 mSv | RRg bei 100 mSv: 0,98 (95 %-KI: 0,82 – 1,17) |
Boice et al. 2011 |
| CEA/AREVA, Frankreich |
1968 – 2004 | 1,0 x 106a | 2 035 | 12,1 mSv | 0,46 (90 %-KI: –0,48 – 1,54) Sv–1 |
Metz-Flamant et al. 2011 |
| EDF, Frankreich | 1968 – 2003 | 4,48 x 105a | 283 | 21,5 mSv | RR bei 100 mSv: 0,71 (90 %-KI: 0,44; 1,06) |
Laurent et al. 2010 |
| Nuklearindustrie, Großbritannien | 1955 – 2001 | 3,9 x 106 | 7 891e | 24,9 mSv | 0,275 (90 %-KI: 0,02 – 0,56) Sv–1 |
Muirhead et al. 2009 |
| Oak Ridge, USA | 1943 – 1984 | 1,37 x 105 | 225 | 15,2 mSv | 4,82 (90 %-KI: 0,41 – 13,31) Sv–1 |
Stayner et al. 2007 |
| Hanford, USA | 1944 – 1994 | – | 2 265 | 27,9 mSv | 0,28 (90 %-KI: –0,30 – 1,00) Sv–1 |
Wing and Richardson 2005 |
| Nuklearindustrie, USA | 1979 – 1997 | 6,98 x 105 | 368 | 25,7 mSv | 0,51 (95 %-KI: –2,01 – 4,64) Sv–1 |
Howe et al. 2004 |
| Nuklearindustrie, Canada | 1957 – 1994 | 6,08 x 105 | 474 | 13,5 mSv | 2,80 (95 %-KI: –0,038 – 7,13) Sv–1 1,77 (95 %-KI: –0,42 – 5,30) Sv–1 |
Zablotska et al. 2004 Zablotska et al. 2012 |
| Bevölkerung Südural, Russland |
1950 – 1999 | 8,66 x 105 | 1 842 | 30c mGy | 0,92 (95 %-KI: 0,2 – 1,7) Gy–1 |
Krestinina et al. 2005 |
| Arbeiter Tschernobyl, Russland | 1986 – 2002 | – | 651 | 156 mGy | 1,52 (95 %-KI: 0,20 – 2,85) Gy–1 |
Ivanov et al. 2006 |
| Einzelstudien – Kleine Dosisleistung (Inzidenz) | ||||||
| Erhöhte Hintergrundstrahlung, Indien |
1990 – 2005 | 7,37 x 105 | 1 349 | 161 mGy | –0,13 (95 %-KI: –0,58 – 0,46) Gy–1 |
Nair et al. 2009 |
| Arbeiter Tschernobyl, Russland | 1986 – 2005 | 9,90 x 105 | 2 718 | 130 mGy | 0,96 (95 %-KI: 0,28 – 1,72) Gy–1 |
Ivanov et al. 2009 |
| Nuklearindustrie, Großbritannien | 1955 – 2001 | 3,9 x 106 | 10 855e | 24,9 mSv | 0,266 (90 %-KI: 0,04 – 0,51) Sv–1 |
Muirhead et al. 2009 |
| Bevölkerung Südural, Russland |
1956 – 2002 | 5,47 x 105 | 1 836f | 40c mGy | 1,0 (95 %-KI: 0,3 – 1,9) Gy–1 |
Krestinina et al. 2007 |
CEA: Commissariat à l’Énergie Atomique et aux Énergies Alternatives
EDF: Electricité de France
- a
- Produkt aus Personen und mittlerem Follow-up
- b
- Ohne Tumoren, die mit dem Konsum von Alkohol in Verbindung gebracht werden
- c
- Magendosis
- d
- Colondosis
- e
- alle bösartigen Neoplasien ohne Leukämie
- f
- ohne Knochenkrebs
- g
- Relatives Risiko
B.2 Studie zur Mortalität der Atombombenüberlebenden (Ozasa et al. 2012)
In regelmäßigen Abständen wird von der Radiation Effects Research Foundation (RERF) ein Bericht mit den aktuellsten Ergebnissen der sogenannten Life Span Study (LSS), der epidemiologischen Auswertung der Daten der Atombombenüberlebenden von Hiroshima und Nagasaki, veröffentlicht. Die hier diskutierte Veröffentlichung repräsentiert den 14. und aktuellen Bericht in dieser Reihe mit einem um sechs Jahre längeren Follow-up-Zeitraum gegenüber der Publikation von Preston et al. (2003).
Material und Methoden
Die Kohorte der Atombombenüberlebenden umfasste ursprünglich circa 120 000 Überlebende. Davon wurden in der vorliegenden Studie nur diejenigen berücksichtigt, die sich zum Zeitpunkt der Explosionen innerhalb eines Radius von 10 km um die Hypozentren aufgehalten hatten und für die Dosiswerte vorhanden waren (insgesamt 86 611 Überlebende). Die verwendeten individuellen Dosiswerte stammten vom aktuellen Dosimetriesystem DS02, wobei für die kombinierte Analyse aller soliden Tumoren die Dickdarmdosis, die sich aus der Summe der Gamma-Energiedosis und dem zehnfachen der Neutronen-Energiedosis ergab, verwendet wurde. Für Fälle mit Dosiswerten größer als 4 Gy (317 Personen) wurde ein Dosiswert von 4 Gy angenommen.
Die Autoren wandten für die Auswertung der gruppierten Daten Poisson-Regression an und analysierten die Abhängigkeit des Risikos von der Dosis unter Berücksichtigung der Parameter Stadt, Geschlecht, Alter bei Exposition und erreichtes Alter. Ihre Modelle erlaubten die Bestimmung des zusätzlichen absoluten und relativen Risikos, wobei die Autoren eine lineare, linear-quadratische und rein quadratische Abhängigkeit mit der Dosis und auch mögliche Dosisschwellen untersuchten.
Ergebnisse
Im Untersuchungs-Zeitraum (1950 bis 2003; 3,29 x 106 Personenjahre) verstarben 58 % der Mitglieder der Kohorte, allerdings waren noch etwa 80 % derer, die zum Zeitpunkt der Explosionen jünger als 20 Jahre alt waren, am Leben. Von den 50 620 Todesfällen waren 10 929 (22 %) auf solide Tumoren zurückzuführen, und es ergab sich für die Kohorte ein ERR-Wert pro Dosis von 0,47 (95 %-KI: 0,38 – 0,56) Gy–1. Dies entspricht für ein Alter bei
Exposition von 30 Jahren und ein erreichtes Alter von 70 Jahren einem geschlechtsgemittelten ERR-Wert pro Dosis von 0,42 (95 %-KI: 0,32 – 0,53) Gy–1. Dies deutet bereits auf eine Altersabhängigkeit des strahleninduzierten relativen Risikos hin, das laut den Autoren für solide Tumoren je zehn Jahre höherem Alter bei Exposition um etwa 29 % bzw. mit einem Exponenten von –0,86 des erreichten Alters abnahm. In Bezug auf das absolute Risiko ergab sich für alle soliden Tumoren zusammen ein EAR-Wert pro 104 Personenjahre und Dosis von 26,4 (95 %-KI: 20,3 – 32,8) (wieder geschlechtsgemittelt für ein Alter bei Exposition von 30 Jahren und ein erreichtes Alter von 70 Jahren). Im Gegensatz zum relativen Risiko ergab sich für die EAR-Werte keine Abhängigkeit vom Geschlecht. Dagegen fanden sich negative Zusammenhänge mit dem Alter bei Exposition und positive mit dem erreichten Alter. So nahmen die EAR-Werte je zehn Jahre höherem Alter bei Exposition um etwa 19 % ab, jedoch signifikant mit dem erreichten Alter gemäß einer Potenzfunktion mit einem Exponenten von 3,4 zu.
Wurde der gesamte Dosisbereich berücksichtigt, lieferte ein lineares ERR-Dosismodell den besten Fit der Daten zur Mortalität an soliden Tumoren (Abbildung B.2.1). Dagegen ergab die Anpassung eines linear-quadratischen Modells für den begrenzten Dosisbereich von 0 bis 2 Gy eine signifikante Krümmung. Interessanterweise waren die Punktschätzer der ERR-Werte pro Dosis im Dosisbereich kleiner 0,3 Gy höher (wenn auch nicht statistisch signifikant) als die Steigung, die sich bei einem linearen Model im Bereich 0 bis 2 Gy oder 0 bis 4 Gy ergab. Die kleinste Dosiskategorie, bei der sich mit 0,56 (95 %-KI: 0,15 – 1,04) Gy–1 ein von Null signifikant verschiedener ERR-Wert pro Dosis ergab, war 0 bis 0,2 Gy. Dieser Wert beinhaltete 74 444 Überlebende mit 9 063 Todesfällen durch solide Tumoren. Hinweise für eine Dosisschwelle wurden nicht gefunden.

Abbildung B.2.1: Zusätzliches relatives Risiko (ERR) für alle Tumoren als Funktion der Dickdarmdosis
(Gamma-Energiedosis plus der mit einem Faktor von 10 gewichteten Neutronen-Energiedosis).
Schwarze Kreise entsprechen ERR-Werten mit den zugehörigen 95 %-Konfidenz-Intervallen
(KI) für die gewählten Dosisgruppen. Durchgezogene Linien: lineares Modell (L) (inkl. 95 %-KI,
dargestellt als gestrichelte Linien) und linear-quadratisches (LQ) Modell, jeweils
für den gesamten Dosisbereich, bzw. linear-quadratisches (LQ(< 2 Gy)) Modell für den
Dosisbereich 0 bis 2 Gy.
Diskussion
In einer früheren Arbeit, in der die Folgen der Dosisrevision von DS86 auf DS02 untersucht wurden, ergab sich für alle soliden Tumoren zusammen und einem Beobachtungszeitraum von 1950 bis 2000 auf der Basis von DS02 ein ERR-Wert pro Dosis von 0,42 Gy–1 (Preston et al. 2004), was mit dem Ergebnis der vorliegenden Studie übereinstimmt. Da nur die ERR-Werte eine signifikante Abhängigkeit vom Geschlecht zeigen, vermuten die Autoren, dass die geschlechtsabhängigen Spontanraten dafür verantwortlich sind.
Auf den ersten Blick scheint die gefundene signifikante Krümmung im Dosisbereich 0 bis 2 Gy für einen DDREF größer 1 zu sprechen („… so that this upward curvature may imply a DDREF greater than one“). Die Autoren betonen jedoch, dass diese Krümmung durch unerklärlich niedrige Werte im Bereich 0,3 Gy bis 0,7 Gy zustande kam, und dass bei niedrigeren Dosen dagegen unerklärlich hohe Werte auftraten.
B.3 Übersichtsartikel
In den letzten Jahren wurde eine größere Zahl von epidemiologischen Studien veröffentlicht, in denen die Krebsrisiken nach Exposition mit niedrigen Dosen und kleinen Dosisleistungen ionisierender Strahlung näher untersucht wurden. Da die statistische Aussagekraft dieser einzelnen Studien oft zu gering ist, wurde in einigen Veröffentlichungen versucht, einige dieser Studien zusammenfassend im Rahmen einer „Meta-Analyse“ auszuwerten.
B.3.1 Die Studie von Akiba und Mizuno 2012
Die Ergebnisse dieser Studie im Hinblick auf die Kohorte der Beschäftigten in der japanischen Nuklearindustrie werden weiter unten im Kapitel „Einzelstudien – Mortalität“ beschrieben. Zusätzlich berichten Akiba und Mizuno in dieser Arbeit von einer Meta-Analyse, bei der sie ihre an den Beschäftigten in der japanischen Nuklearindustrie erzielten Ergebnisse jedoch nicht mit einbezogen. Generell liegt eine der Stärken der Studien an den Beschäftigten in Nuklearanlagen darin, dass zur Dosisrekonstruktion auf Messdaten der regulären Strahlenschutz-Überwachung zurückgegriffen werden kann.
Material und Methoden
Die Meta-Analyse beschränkte sich auf Studien an Beschäftigten in der Nuklearindustrie (ohne Einschluss der japanischen Daten), bei denen ERR-Werte pro Dosis für alle Krebsarten außer Leukämie oder für solide Tumoren angegeben wurden. In allen diesen Studien waren die Analysen unter der Annahme einer linearen Dosis-Wirkungsbeziehung durchgeführt worden. Studien mit weniger als 100 Krebstodesfällen wurden ausgeschlossen. Es wurden alle Einrichtungen berücksichtigt, die auch in der 15-Länder-Studie (Cardis et al. 2005, 2007) analysiert wurden, wobei, wenn verfügbar, neuere Ergebnisse verwendet wurden. Eine Ausnahme bildete die Kohorte der in der kanadischen Nuklearindustrie Beschäftigten, für die die Daten, die auch in die 3-Länder-Studie (Cardis et al. 1995) Eingang fanden, verwendet wurden. Für diese Daten wurde damals nicht die Werte des kanadischen Dosisregisters verwendet, die sich nach Veröffentlichung der 15-Länder-Studie als problematisch herausstellten (Ashmore et al. 2010).
Ergebnisse
Die Autoren berücksichtigten neun Studien mit insgesamt mehr als 15 000 Krebstodesfällen: Cardis et al. 1995 (AECL, Canada), Richardson und Wing 1999 (ORNL, US), Howe et al. 2004 (Nuclear Power Plants, US), Wing und Richardson 2005 (Hanford, US), Schubauer-Berigan et al. 2005 (INEEL, US), Boice et al. 2011 (Rocketdyne, US), Metz-Flamant et al. 2011 (COGEMA, France), Muirhead et al. 2009 (Nuclear Registry for Radiation Workers, UK) und Laurent et al. 2010 (EDF, France).
Ein Gesamt-Schätzer unter Verwendung aller neun Studien wird nicht angegeben. Werden die Daten von Schubauer-Berigan et al. (INEEL, US), die einen deutlich negativen Wert ergaben (–1,5; Standardfehler 0,44), nicht berücksichtigt, ergab sich ein ERR-Wert pro Dosis von 0,14 (95 %-KI: –0,12 – 0,41) Sv–1.
Diskussion
Die Autoren betonen, dass das Ergebnis ihrer Meta-Analyse basierend auf der LNT-Annahme ähnlich ist zu dem, das sie bei der Auswertung der japanischen Kohorte (ohne Leukämie und Tumoren, die mit dem Konsum von Alkohol in Verbindung gebracht werden) erhielten (siehe unten). Sie zeigen, dass ein Ausschluss des relativ hohen Werts der ORNL-Studie (Richardson und Wing 1999) den Gesamtschätzer deutlich reduziert auf einen Wert von 0,03 pro Sv. Es sei jedoch darauf hingewiesen, dass eine deutlich aktuellere Auswertung der ORNL-Daten, die sie nicht berücksichtigten, für den ERR-Wert pro Dosis einen hohen Wert bestätigte (Stayner et al. 2007, siehe unten).
Die Autoren betonen, dass, wie sie in der Analyse der japanischen Daten zeigten, Tumoren, die mit dem Konsum von Alkohol in Verbindung gebracht werden, das Gesamt-Ergebnis deutlich beeinflussen können, und dass keine der in ihrer Meta-Analyse verwendeten Studien dies berücksichtigte. Sie vermuten, dass die Rolle von Alkohol und Rauchen darauf zurückgeführt werden könnte, dass die Wirkung beider Faktoren durch eine Wechselwirkung mit ionisierender Strahlung verstärkt sein könnte. Die Evidenz für eine solche Wechselwirkung ist allerdings bisher insgesamt als schwach zu bezeichnen.
B.3.2 Die Studie von Ogata 2011
Material und Methoden
In dieser Studie wurde die Online-Datenbank PubMed verwendet, wobei der Autor im März 2010 nach epidemiologischen Studien suchte, die seit dem Jahr 2000 veröffentlicht worden waren. Dazu verwendete er die folgenden Suchbegriffe: „carcinogens“, „risk“, „low dose“ und „epidemiology“. Auf diese Weise identifizierte er 72 Studien, von denen zehn epidemiologische Studien mit einem Schwerpunkt auf niedrige Dosen übrig blieben, und bei denen ERR-Werte pro Dosis angegeben wurden. Diese Werte wichtete der Autor entsprechend der Konfidenz-Intervalle und untersuchten Endpunkte (u. a. solide Tumoren), um schließlich einen Schätzwert des Risikos der gepoolten Studie zu bekommen.
Ergebnisse
Für solide Tumoren zusammen wurden die folgenden Studien identifiziert: die Studie von Nair et al. zur Krebsinzidenz an den Bewohnern von Kerala in Indien (Nair et al. 2009) („Cancer excluding leukemia“), die von Krestinina et al. zur Krebsmortalität an den Bewohnern entlang der Tetscha (Krestinina et al. 2005) („solid cancer“), die von Howe et al. zur Mortalität bei Beschäftigten in der US-Nuklearindustrie (Howe et al. 2004) („solid cancer“) sowie die von Zablotska et al. zur Mortalität bei Beschäftigten in der kandischen Nuklearindustrie (Zablotska et al. 2004) („solid cancer“). Die in den Einzelstudien gewonnenen ERR-Werte pro Dosis wurden tabellarisch zusammengestellt.
Diskussion
Obwohl der Autor im Abstract behauptet, aus den Einzelstudien zusammenfassende Risikoschätzer berechnet zu haben („Integrated risk indices were derived from those data …“), gibt er nur für Leukämie einen gepoolten Schätzer, und auch nur grafisch, an. Zusammenfassende Ergebnisse für solide Tumoren werden nicht gezeigt. Zudem wurde durch die durchgeführte Literaturrecherche eine große Anzahl an epidemiologischen Studien nicht identifiziert. Die Arbeit ist daher für den Zweck des vorliegenden Überblicks unbrauchbar.
B.3.3 Die Studie von Jacob et al. 2009
Material und Methoden
Ziel der Studie war es, die Evidenz des Krebsrisikos durch kleine Dosisleistungen ionisierender Strahlung zu überprüfen. Dazu sollten das zusätzliche relative Risiko (ERR) für Krebs (exklusive Leukämien) pro Dosis von entsprechenden epidemiologischen Studien mit dem geschätzten ERR, wie es sich mit Hilfe der Daten der Atombombenüberlebenden ermitteln lässt, verglichen werden.
Dazu nutzen Jacob und Mitautoren die Online-Datenbank PubMed der National Library of Medicine, wobei nicht direkt erkennbar wird, ob eine Beschränkung auf englischsprachige Literatur erfolgte. Andere Datenbanken, wie zum Beispiel die Datenbank CANCERLIT, eine im Krebsbereich umfassendere Literaturdatenbank des National Cancer Institutes, wurden nicht verwendet. Die Autoren suchten relevante Veröffentlichungen unter Verwendung spezieller Suchbegriffe, wie z. B. „cancer“, „radiation“, „occupation“, „work“, „personnel“, „environmental“ oder „emergency“. Zusätzlich verwendeten sie eine Reihe von Ausschlusskriterien, die jedoch nicht explizit benannt wurden. Im Rahmen einer Befragung durch die Arbeitsgruppe „Dosis- und Dosisleistungs-Effektivitätsfaktor (DDREF)“ des Ausschusses „Strahlenrisiko“ der SSK erläuterten die Autoren ihre Literaturrecherche: „radiation AND cancer AND (2002 [dp] OR 2003 [dp] OR 2004 [dp] OR 2005 [dp] OR 2006 [dp] OR 2007 [dp]) AND (occupation* OR work* OR personnel OR Environmental OR emergency OR liquidator*) NOT biology NOT vivo NOT molecular NOT DNA NOT Radiosensiti* NOT Solar NOT palliative NOT chemotherapy NOT cosmic NOT diagnos* NOT therapy“. Dies ergab am 2. Mai 2007 anfänglich 714 Treffer. Die Suche wurde ergänzt durch eine manuelle Recherche, die nicht näher beschrieben wurde und zwei zusätzliche relevante Studien ergab. Eine weitere Studie wurde auf Anregung eines der Gutachter der Publikation mit aufgenommen. Nach Beschränkung auf Kohorten- und Fall-Kontroll-Studien und auf Übersichtsartikel blieben 123 Publikationen übrig. Im Anschluss daran wurden Studien an Kindern und zu einzelnen Tumoren bzw. solche mit fehlenden Angaben von Dosis oder von relativen Risiken und Standardfehlern etc. ausgeschlossen. Studien von internen Expositionen mit Alphastrahlung wurden ebenso ausgeschlossen wie Studien mit einem großen Anteil von Hochexponierten – dieser Anteil wurde jedoch nicht explizit spezifiziert. Schließlich identifizierten Jacob und Mitautoren neun Veröffentlichungen zur Krebsmortalität und drei zur Krebsinzidenz, die sie für ihre weiteren Analysen verwendeten. Eine Bewertung der Qualität dieser Studien erfolgte dabei nicht. Eine Ausnahme bildete die 15-Länder-Studie von Cardis et al. (2005) (siehe unten), von der Jacob et al. für ihre Analyse die kanadischen Daten nicht berücksichtigten, weil damals bereits klar war, dass für die kanadische Kohorte ein Problem bei der Dosimetrie aufgetreten war.
Um mit den Daten der Atombombenüberlebenden vergleichen zu können, verwendeten Jacob und Mitautoren die öffentlich zugänglichen Daten zur Krebsmortalität (Follow-up-Zeitraum: 1950 bis 2000) und Krebsinzidenz (Follow-up-Zeitraum von 1958 bis 1998). Mittels dieser Daten berechneten sie den ERR-Wert pro Dosis, wobei sie jedoch nicht das Geschlechtsverhältnis, das Alter bei Exposition und das tatsächliche Alter für die Atombombenüberlebenden verwendeten, sondern die entsprechenden Werte, die für die jeweilige Einzelstudie typisch waren. Für die Einzelstudien wurde als Surrogat für Alter bei Exposition das Alter bei Beginn des Follow-ups verwendet. Weitere Annahmen wurden entsprechend der Standardauswertung der Überlebenden getroffen (z. B. nur Überlebende mit Dosen < 4 Gy (shielded kerma); Gewichtung für die Neutronendosis mit einem Faktor 10). War die Dosisgröße in einer Einzelstudie eine Organdosis, wurde diese auch für die Atombombenüberlebenden verwendet. Wurden in einer Einzelstudie dagegen Dosiswerte auf Grund von TLD- oder Filmdosimeter angegeben, wurde für die Überlebenden die Hautdosis verwendet. Die Autoren begründen dieses Vorgehen mit der Tatsache, dass berechnete Dosiskonversions-Koeffizienten für die Personenäquivalentdosis (angegeben pro Kerma in Luft) im Photonenenergiebereich zwischen 100 keV und einigen MeV, der für die Atombombenüberlebenden relevant ist, für AP- und ROT-Geometrie innerhalb 10 % übereinstimmen mit den entsprechenden Dosiskonversions-Koeffizienten für die Haut.
Als Effektmaß zogen Jacob et al. den Quotient aus dem ERR-Wert pro Dosis der Einzelstudie (bezeichnet als ßldrmdi) und dem auf Basis der Daten der Atombombenüberlebenden berechneten (bezeichnet als ßlssi) heran. Somit wurde pro Einzelstudie qi = ßldrmdi/ßlssi berechnet. Die Varianz für qi wurde mit Hilfe von Monte-Carlo-Simulationen bestimmt. Für die Meta-Analyse wurden diese aus den einzelnen Studien berechneten qi-Werte dann statistisch mit Hilfe der inversen Varianz-Methode gepoolt und ein Gesamtwert Q ermittelt. Ein Wert von 0,5 für Q entspräche einem DDREF-Faktor von 2, wie er von der ICRP gegenwärtig propagiert wird. Als Sensitivitätsanalyse wurden einzelne Studien von den Hauptanalysen ausgeschlossen. Die Heterogenität zwischen den Studien wurde mit Hilfe der Cochran’s Q Statistik ermittelt. Zur Ermittlung der Lebenszeit-Risken wurden Annahmen zur Korrelation zwischen lrBEIRVII und DDREFBEIRVII getroffen (negativer Korrelationskoeffizient von –0,5). Aufgrund der Unsicherheit bezüglich dieser Annahme erfolgten Sensitivitätsanalysen mit Korrelationskoeffizienten zwischen 0 und –1.
Ergebnisse
Alle zwölf analysierten Einzelstudien waren Kohortenstudien, neun zur Mortalität und drei zur Inzidenz. Insgesamt waren darunter sieben Studien an Beschäftigten in der Nuklearindustrie, drei Studien zu Aufräumarbeitern, die in Tschernobyl eingesetzt waren, und zwei Studien an Bewohnern entlang des Tetscha-Flusses im Süd-Ural. Acht der neun Punktschätzer für qi der einzelnen Studien zur Mortalität waren größer als 0,5, einer hatte den Wert 0. Zudem waren alle drei Punktschätzer für qi der einzelnen Studien zur Inzidenz größer als 0,5. Keine der Studien beinhaltete eine wesentliche Anzahl an Personen mit Dosen von mehr als einigen wenigen hundert mGy. Für das gepoolte Verhältnis Q ergab sich für Mortalität ein Wert von 1,21 (90 %-KI: 0,51 – 1,90), für Inzidenz ein Wert von 0,98 (90 %-KI: 0,41 – 1,54). Wurden im Rahmen einer Sensitivitätsanalyse eine der Einzelstudien nicht berücksichtigt, änderte sich das Ergebnis für Q um maximal 26 %. Am niedrigsten war der Punktschätzer für Mortalität, wenn die Studie an den Bewohnern entlang des Tetscha-Flusses (0,96), am höchsten, wenn die Studie an den Nukleararbeitern in Großbritannien unberücksichtigt blieb (1,44).
Die Ergebnisse der Sensitivitätsanalyse hinsichtlich der negativen Korrelation zwischen lrBEIRVII und DDREFBEIRVII unterschieden sich kaum, nur die Weite der Konfidenz-Intervalle änderte sich um ± 30 %.
Diskussion
Die Autoren betonen als Stärken ihrer Studie, dass sich ein signifikant erhöhtes Risiko nach Exposition mit niedrigen Dosen und kleinen Dosisleistungen ergab, das zudem nicht niedriger ist als das der Atombombenüberlebenden, und dass diese Ergebnisse sich nicht wesentlich änderten, wenn eine der Einzelstudien aus der Analyse ausgeschlossen wurde. Dies ist insbesondere von Bedeutung, da bei den meisten der Einzelstudien methodische Probleme zum Beispiel bei der Dosimetrie nicht ausgeschlossen werden können. Auch das Fehlen von Informationen zu Confoundern, wie das Rauchen, könnte die Einzelwerte zum ERR pro Dosis beeinträchtigen, wobei qi-Werte als Verhältniswerte nicht so stark betroffen sein sollten, da auch für die Daten zu Atombombenüberlebenden derartige Informationen nicht verfügbar waren.
Generell äußern sich Jacob und Mitautoren nicht zu den Limitationen der einzelnen epidemiologischen Studien, erwähnen jedoch folgende Aspekte: Qualitativ begrenzte Dosimetrie, fehlende Berücksichtigung von Confoundern (z. B. Rauchen), Diversizität der Expositionsgruppen und Krebserkrankungsgruppen und Probleme bei der Definition von „Alter bei Exposition“. Eine formale Evaluation eines möglichen Publikationsbias wird nicht präsentiert. Es wird auch nicht angesprochen, dass möglicherweise relevante Publikationen wegen unzureichender Literaturrecherche nicht in die Meta-Analyse eingeschlossen wurden. Die Autoren sehen zudem keine Limitationen in den diversen statistischen Modellannahmen, die für die präsentierten Analysen erforderlich waren.
Die Autoren schließen mit der Feststellung, dass die meisten der untersuchten Einzelstudien mit dem BEIR VII-Bericht (2006) und den ICRP-Empfehlungen (2007) kompatibel sind, nicht zuletzt auf Grund ihrer begrenzten statistischen Power. Das kombinierte Risikoverhältnis Q ist ebenfalls kompatibel mit dem BEIR VII-Bericht und den ICRP-Empfehlungen, jedoch größer („The recent epidemiological studies analyzed here provide some evidence that cancer risks associated with LDRMD exposures to ionzing radiation may be greater than those published by BEIR VII and ICRP“).
B.3.4 Beschäftigte in der Nuklearindustrie von 15 Ländern (Cardis et al. 2005, 2007)
Material und Methoden
Die Nuklearindustrie beschäftigt weltweit aktuell mehrere hunderttausend Personen, die oft über längere Zeit niedrigen Dosen und kleinen Dosisleistungen ausgesetzt sind. In die Analyse wurden Kohorten aus 15 Ländern (Cardis et al. 2005, 2007; Vrijheid et al. 2007, Thierry-Chef et al. 2007) eingeschlossen, für die ein weitgehend vollständiges und nicht selektives Follow-up sowie jährliche individuelle Dosisdaten der überwachten Arbeiter mit Angaben zur Dosisbestimmung von externer Photonenstrahlung (X und γ) vorhanden waren. Die Einschlusskriterien waren eine Mindestbeschäftigungszeit von einem Jahr (mit länderspezifischer Modifikation) und eine überwiegend externe Exposition mit hochenergetischen Photonen (Vrijheid et al. 2007).
Insgesamt waren 598 068 Arbeiter in den berücksichtigten 154 Nuklearanlagen beschäftigt. Angaben zum Vitalstatus wurden aus regionalen oder nationalen Registern ermittelt, die Todesursachen durch Abgleich mit Todesursachenregistern. Die Follow-up-Rate der Einzelkohorten lag zwischen 87 % und 100 %, wobei für mehr als 90 % aller Verstorbenen die Todesursache ermittelt werden konnte.
Für jedes einzelne Kohortenmitglied wurde die Dosis rekonstruiert anhand der Daten der Anlagenbetreiber bzw. der nationalen Dosisregister. Personen mit einem höheren Anteil interner Expositionen (39 730 Personen) und Neutronenexpositionen (19 041 Personen) wurden von der Auswertung ausgeschlossen. Für die Analysen des Auftretens solider Tumoren wurden Lungen- und Kolondosen verwendet, und in den epidemiologischen Auswertungen die individuellen Jahresdosen der Arbeiter auf die in der Publikation von Thierry-Chef et al. (2007) ermittelten Dosis-Fehler adjustiert.
In deskriptiven Auswertungen wurden standardisierte Mortalitätsquotienten (standardised mortality ratio, SMR) berechnet. Zur Schätzung des Risikokoeffizienten (zusätzliches relatives Risiko je Dosis) setzten die Autoren ein Poisson-Regressionsmodell ein, wobei sie von einer linearen Dosis-Wirkungsbeziehung ausgingen. Mögliche Abweichungen von einer linearen Beziehung wurden unter Verwendung polynomischer Abhängigkeiten untersucht. Elf a priori definierte Dosiskategorien wurden genutzt und die Risikoschätzer für Alter, Geschlecht, Kalenderperiode, Beschäftigungsdauer und sozio-ökonomischen Status stratifiziert. Für solide Tumoren wurde eine Latenzzeit von zehn Jahren angenommen.
Die Analysen schlossen unter anderem alle Tumoren außer Leukämie, alle soliden Tumoren (zum Vergleich mit Daten der Atombombenüberlebenden) – darunter die mit Tabak assoziierten und nicht mit Tabak assoziierten soliden Tumoren – ein. Da keine direkten Angaben zum Rauchen vorlagen und Rauchen und Sozialstatus korreliert sind, nutzten die Autoren den in den meisten Kohorten erhobenen Sozialstatus zur indirekten Adjustierung für das Rauchen.
Ergebnisse
In die Analyse eingeschlossen wurden 407 391 Arbeiter, die knapp 5,2 Millionen Personenjahre beitrugen. Die mittlere kumulative Lebenszeit-Exposition betrug 19,4 mSv (Tabelle B.3.1). 90 % der Arbeiter erhielten Dosen unter 50 mSv und weniger als 0,1 % Dosen über 500 mSv. Aufgrund der geringen Anzahl von Frauen in den Kohorten sind die Ergebnisse als vornehmlich auf Männer bezogen zu werten.
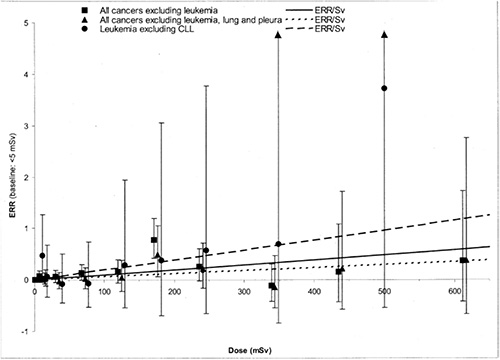
Abbildung B.3.1: Zusätzliches relatives Risiko als Funktion der in Cardis et al. (2007) verwendeten
Dosiskategorien (relativ zur < 5 mSv Dosis-Kategorie) einschließlich 90 %-KI.
Insgesamt wurden 24 158 Todesfälle, davon 6 519 Krebsfälle (1 457 Lungenkrebsfälle) ohne Leukämie, registriert. Die SMR-Auswertungen deuteten auf einen zum Teil ausgeprägten Healthy-Worker-Effekt mit erniedrigten SMR in allen Teilkohorten hin. Bei den dosisbezogenen Auswertungen ergab sich für alle Tumoren außer Leukämie in der relevanten Dosisgruppe < 400 mSv ein Risikokoeffizient von 1,18 (90 %-KI: 0,37 – 2,11) Sv–1. In der Gesamtkohorte lag der Risikokoeffizient für die soliden Tumoren bei 0,87 (90 %-KI: 0,16 − 1,71) Sv–1. Die Autoren konnten keine Abweichung von einer linearen Dosisabhängigkeit finden („Analyses using polynomials in dose … did not reveal significant departure from linearity …“). Dies wird in Abbildung B.3.1 verdeutlicht, die unter anderem die kategorielle Abhängigkeit des zusätzlichen relativen Risikos pro Dosis für alle Tumorarten ohne Leukämie zeigt.
Auf der Basis von Abbildung B.3.1 schließen die Autoren, dass die Aussagekraft der Studie zu gering ist, um die Dosisabhängigkeit des zusätzlichen relativen Risikos genauer untersuchen zu können („…Further, the power of the study is inadequate to investigate the shape of the dose response, even in the dose range under study.“).
Der erhöhte Risikokoeffizient der mit Tabak assoziierten Tumoren wurde wesentlich durch das Risiko für Lungenkrebs (1,86 [95 %-KI: 0,26 − 4,01] Sv–1) verursacht. Außer für Lungenkrebs ermittelten die Autoren für keine Einzellokalisation statistisch signifikante Risikokoeffizienten.
Bei den Auswertungen für alle Tumoren ohne Leukämie nach Alter bei Exposition wurden die höchsten Risikoschätzer für Expositionen im Alter über 50 gefunden. In dieser Gruppe lag das zusätzliche relative Risiko bei 1,74 (90 %-KI: 0,24 – 3,58) Sv–1. Der Trend über die drei Altersgruppen (< 35, 35 − 50, > 50) war jedoch nicht signifikant (p = 0,23).
Tabelle B.3.1: Zusammenstellung der grundlegenden Daten der einzelnen Studien der 15-Länder-Studie nach Cardis et al. (2007).
| Land/Einrichtung | Follow-up- Periode |
Anzahl Beschäftigte |
Todesfälle | Durchschnittl. individuelle kumulative Dosis (mSv) |
||
|---|---|---|---|---|---|---|
| Alle Ursachen | Alle Tumoren außer Leukämie | Leukämie außer CLL |
||||
| Australien | 1972 – 1998 | 877 | 56 | 17 | 0 | 6,1 |
| Belgien | 1969 – 1994 | 5 037 | 322 | 87 | 3 | 26,6 |
| Kanada | 1956 – 1994 | 38 736 | 1 204 | 400 | 11 | 19,5 |
| Finnland | 1971 – 1997 | 6 782 | 317 | 33 | 0 | 7,8 |
| Frankr. CEA-COGEMA | 1968 – 1994 | 14 796 | 645 | 218 | 7 | 3,8 |
| Frankreich EDF | 1968 – 1994 | 21 510 | 371 | 113 | 4 | 15,8 |
| Ungarn | 1985 – 1998 | 3 322 | 104 | 39 | 1 | 5,1 |
| Japan | 1986 – 1992 | 83 740 | 1 091 | 413 | 190 | 18,2 |
| S. Korea | 1992 – 1997 | 7 892 | 58 | 1 | 0 | 15,5 |
| Litauen | 1984 – 2000 | 4 429 | 102 | 24 | 1 | 40,7 |
| Slowakei | 1973 – 1993 | 1 590 | 35 | 10 | 0 | 18,8 |
| Spanien | 1970 – 1996 | 3 633 | 68 | 25 | 0 | 25,5 |
| Schweden | 1954 – 1996 | 16 347 | 669 | 190 | 4 | 17,9 |
| Schweiz | 1969 – 1995 | 1 785 | 66 | 24 | 0 | 62,3 |
| Großbritannien | 1955 – 1992 | 87 322 | 7 983 | 2 201 | 54 | 20,7 |
| USA Hanford | 1944 – 1986 | 29 332 | 5 564 | 1 279 | 35 | 23,7 |
| USA INEL | 1960 – 1996 | 25 570 | 3 491 | 886 | 26 | 10,0 |
| USA NPP | 1979 – 1997 | 49 346 | 983 | 314 | 19 | 27,1 |
| USA ORNL | 1943 – 1984 | 5 345 | 1 029 | 225 | 12 | 15,2 |
| Gesamt | 407 391 | 24 158 | 6 519 | 196 | 19,4 | |
CEA-COGEMA: Commissariat à l’Energie Atomique Générale des Matières Nucléaires
EDF: Electricité de France
NPP: Nuclear power plants
INEL: Idaho National Energy Laboratory
ORNL: Oak Ridge National Laboratory
CLL: chronisch lymphatische Leukämie (Cardis et al. 2005)
Diskussion
Die Studie ist die bisher umfassendste gepoolte Auswertung von Studien unter Beschäftigten der Nuklearindustrie. Für alle Krebsarten ohne Leukämie ergab sich ein deutlich höherer Risikoschätzer als aufgrund der Extrapolation von LSS-Daten erwartet. Für die soliden Tumoren wurden 2- bis 3-fach höhere Risikoschätzer als in der LSS-Kohorte gefunden. Risikoschätzer aus Einzelveröffentlichungen zu länderspezifischen Kohorten wie etwa die Arbeit von Howe et al. (2004) zu den US-amerikanischen Kraftwerksarbeiten stützen diese Schätzungen, sind jedoch aufgrund der geringeren Power nicht statistisch signifikant. Sensitivitätsanalysen bezüglich der Risikokoeffizienten deuteten auf einen erheblichen Einfluss der kanadischen Daten hin. Ohne Berücksichtigung der Daten aus Kanada ist der Risikokoeffizient für alle Krebsarten außer Leukämie zwar weiterhin erhöht, aber nicht mehr signifikant (0,58 [95 %-KI: –0,22 − 1,55] Sv–1). Eine erneute Prüfung der kanadischen Daten ergab mittlerweile, dass nur Personen, die vor 1965 bei der Atomic Energy of Canada Limited beschäftigt waren, ein signifikant erhöhtes Risiko pro Dosis für Mortalität an soliden Tumoren aufwies, vermutlich auf Grund unvollständiger Dosisangaben („A group of 3 088 AECL NEWs (nuclear energy workers) first employed before 1965 (1956 – 1964) was the only group of workers with a consistent radiation-associated increase in risk of solid cancer mortality.“ … „It is very likely that these early AECL NEWs have incomplete dose information (i. e., their doses are under-reported.“) (CNSC Report 2011). Zu einem ähnlichen Schluss kamen bereits Ashmore und Mitautoren, die zeigten, dass beim Transfer der AECL-Daten in das Nationale Dosisregister (NDR) Daten von Beschäftigten, für die im Zeitraum 1956 bis 1970 ein Dosiswert von Null aufgezeichnet worden war, nicht weitergegeben wurden (Ashmore et al. 2010). Es zeigte sich außerdem, dass die Wahl der Latenzzeit die sich ergebenden ERR-Werte pro Dosis deutlich beeinflussten. So ergab sich bei einer Latenzzeit von fünf Jahren ein Wert von 0,76 (90 %-KI: 0,07 – 1,59) Sv–1, bei einer Latenzzeit von 20 Jahren dagegen ein Wert von 1,68 (90 %-KI: 0,22 – 3,48) Sv–1. Schließlich zeigte sich ein erheblicher Einfluss des Lungenkrebses auf den ermittelten Risikokoeffizienten für alle soliden Tumoren. Die Autoren selbst halten eine Verzerrung der Mortalitäts-Risikoschätzer durch Rauchen für wahrscheinlich, ohne dass dies die gesamte strahlenassoziierte Risikoerhöhung erklären könnte. Sie schlussfolgern, dass ihre Risikoschätzungen mit denen im Strahlenschutz verwendeten kompatibel sind („Risk estimates per unit dose from this study are statistically compatible with estimates that serve as the basis for current radiation protection standards. They range from values lower than the BEIR VII estimates up to values that exceed these estimates by a factor of about six for both solid cancers and leukemia.“).
B.4 Einzelstudien – Mortalität
B.4.1 Bewohner in Guangdong, China (Tao et al. 2012)
Material und Methoden
In dieser Studie, die eine Aktualisierung einer früheren Arbeit darstellt (Sun et al. 2000), wurden 31 604 Bewohner, davon 15 559 Frauen, aus drei Gegenden Chinas untersucht. Zwei dieser Gegenden (Tongyou und Donganling) sind für eine erhöhte terrestrische Dosisleistung bekannt, eine (Enping) diente als Kontrolle. Die Familien der meisten Personen lebten in diesen Gegenden bereits über sechs oder mehr Generationen. Bei Studienbeginn Anfang 1979 waren die Teilnehmer zwischen 30 Jahre und 74 Jahre alt. Auf der Basis von ausgefüllten Fragebögen besuchte eine Expertengruppe die lokalen Krankenhäuser, Hausärzte und Familienmitglieder, um wenn nötig zusätzliche Informationen zu den Todesursachen zu sammeln. Der Follow-up begann am 1. Januar 1979 und endete entweder am 31. Dezember 1998 oder zum 75. Geburtstag des Betreffenden.
In etwa einem Drittel der involvierten Haushalte wurde die Dosisleistung in Wohn- und Schlafzimmer sowie in der Küche mit Szintillationszählern gemessen. Die Dosisleistung im Freien bestimmten die Autoren an den wichtigsten Plätzen, wie z. B. Hauptstraßen, Parks, Reisfeldern usw. Auf der Basis von Fragebögen von knapp 5 300 Personen wurden für die Studiengegend repräsentative Aufenthaltsdauern im Haus und im Freien bestimmt. Daraus errechneten sich dann zusammen mit den gemessenen Dosisleistungen individuelle Expositionen, wobei auf die Exposition durch kosmische Strahlung korrigiert wurde. Eine Bestimmung interner Expositionen erfolgte nicht. Die für die Auswertung verwendeten Dickdarmdosen ergaben sich dann unter Verwendung von Dosis-Konversionsfaktoren der ICRP.
Die statistische Auswertung der Daten erfolgte mittels Poisson-Regression unter Verwendung des Programms AMFIT, wobei die folgenden Parameter berücksichtigt wurden: Geschlecht, Alter (5-Jahres-Kategorien), Follow-up-Zeitraum (fünf Kategorien), Dosis (sechs Gruppen). Als Todesursachen wurde zwischen verschiedenen Arten solider Tumoren, Leukämie und Nicht-Krebserkrankungen unterschieden. Informationen zum sozio-ökonomischen Status wurden nicht berücksichtigt. Wie in den meisten der hier beschriebenen Studien nahmen die Autoren für alle Krebsarten außer Leukämie eine Latenzzeit von zehn Jahren an und verwendeten ein lineares Dosis-Wirkungsmodell.
Ergebnisse
Bei insgesamt 736 942 Personenjahren verstarben 956 Personen an Krebs, 15 davon an Leukämie. In den drei untersuchten Gegenden waren die Studienteilnehmer mittleren kumulierten Dickdarmdosen von 21,6 mGy (Enping), 88,5 mGy (Tongyou) und 81,7 mGy (Donganling) ausgesetzt. Diese Werte stimmen laut Autoren sehr gut mit denen überein, die in einer früheren Studie bei ca. 5 200 Bewohnern der untersuchten Gegenden, die ein Thermolumineszenz-Dosimeter getragen hatten, erzielt wurden. Die am häufigsten diagnostizierten Krebsarten waren bei Männern und Frauen Krebs der Leber und des Mundrachenraums. Auffällig war ein signifikant negativer ERR-Wert pro Dosis von –3,38 Gy–1 für Leberkrebs, wobei die Autoren darauf hinweisen, dass eine eindeutige Diagnose der Todesursache Leberkrebs häufig schwierig sei. Sie bevorzugen daher eine Auswertung ihrer Daten ohne Leberkrebs und geben dann für alle Krebsarten (ohne Leukämie und Leberkrebs) einen ERR-Wert pro Dosis von 0,19 (95 %-KI: –1,87 – 3,04) Gy–1 an.
Diskussion
Das Design der Studie ähnelt in vielen Punkten dem der Studie von (Nair et al. 2009) an den Bewohnern in Kerala, Indien (siehe unten). Die Autoren führten daher eine sogenannte Meta-Analyse ihrer Studie und der von Nair et al. durch und bekamen einen kombinierten ERR-Wert pro Dosis von –0,12 (95 %-KI: –0,69 – 0,46) Gy–1, der kaum von dem Ergebnis der indischen Studie abweicht, da diese aufgrund ihrer größeren Power ein höheres Gewicht in der gemeinsamen Auswertung hat.
Einen Nachteil ihrer Studie sahen die Autoren in der Tatsache, dass sie interne Expositionen, die in den Gegenden mit erhöhter natürlicher Exposition 4,27 mSv pro Jahr und in der Kontroll-Gegend 1,65 mSv pro Jahr ausmachen, nicht berücksichtigten. Sie betonten jedoch, dass nur für Radon ein Zusammenhang mit dem Auftreten von Lungenkrebs nachgewiesen wurde. Auf Grund der relativ niedrigen Radon-Raumluftkonzentrationen erwarteten sie keinen großen Einfluss von Radon auf die ERR-Werte für Lungenkrebs und konnten diesen in ihren Daten auch nicht finden.
Die Autoren waren der Meinung, dass ihr Ergebnis mit den strahleninduzierten Risiken, die an den Atombombenüberlebenden abgeleitet wurden, kompatibel ist („Although this estimate was lower than that of 0,47 Gy–1 reported by the study of atomic bomb survivors …, the wide confidence interval of the present study‘s ERR estimate includes atomic bomb survivors‘ ERR estimate“) und schlossen mit der Feststellung, dass sich die von ihnen quantifizierten Risikowerte nicht mit den gegenwärtig propagierten widersprächen („The estimates of cancer risk associated with low dose and dose-rate exposure to low-LET ionizing radiation are not inconsistent with currently accepted risk estimates“).
B.4.2 Beschäftigte in der japanischen Nuklearindustrie (Akiba und Mizuno 2012)
Die Kohorte der Beschäftigten in der japanischen Nuklearindustrie war Teil der 15-Länder-Studie, wurde jedoch von Cardis et al. nicht in die Gesamtauswertung mit aufgenommen, da keine Informationen zum sozio-ökonomischen Status vorlagen (Cardis et al. 2005). In (Cardis et al. 2007) wurden jedoch zumindest ERR-Werte pro Dosis für diese Kohorte angegeben. Die hier diskutierte Veröffentlichung fasst die Ergebnisse der dritten und aktuellsten Auswertung der Krebsmortalität von Beschäftigten in der japanischen Nuklearindustrie zusammen. In dieser Arbeit wurde zudem eine Meta-Analyse durchgeführt, die weiter oben beschrieben wurde.
Material und Methoden
Die Studie umfasste 200 583 männliche Beschäftigte, die im Zeitraum 1991 bis 2002 im Mittel 6,8 Jahre zum Follow-up beitrugen, entsprechend 1 373 000 Personenjahre.
Die Autoren verwendeten individuelle kumulierte Dosiswerte aus dem japanischen Dosisregister für beruflich exponierte Personen. Mögliche Expositionen aus medizinischen Gründen konnten nicht berücksichtigt werden, obwohl die Mitglieder der Kohorte regelmäßig medizinisch untersucht wurden. Die mittlere, fast ausschließlich externe kumulierte Dosis der Teilnehmer betrug 12,2 mSv, wobei etwa 75 % der Arbeiter Dosen von weniger als 10 mSv und nur 2,6 % Dosen von mehr als 100 mSv aufwiesen. Alle Dosiswerte wurden dem offiziellen Bericht der Radiation Effects Association (REA) entnommen (Radiation Effects Association 2006).
Unter Annahme einer linearen Dosis-Wirkungskurve ohne Schwelle berechneten die Autoren mit Poisson-Regression mittels AMFIT ERR-Werte pro Dosis. Dabei berücksichtigten sie die Parameter Alter, Kalenderjahr (drei Kategorien) und Wohnsitz (acht Teilgebiete Japans) und verwendeten für solide Tumoren eine Latenzzeit von zehn Jahren. Um einen Einfluss von Alkohol- und Tabakkonsum zu quantifizieren, wurden ERR-Werte pro Dosis auch für alle Krebsarten außer Leukämie und Tumoren, die mit dem Konsum von Alkohol in Verbindung gebracht werden, und für alle Krebsarten außer Leukämie und Tumoren, die mit dem Rauchen in Verbindung gebracht werden, berechnet. Zu Tumoren, die mit dem Konsum von Alkohol in Verbindung gebracht werden, zählten die Autoren entsprechend der IARC-Definition Tumoren des oberen Verdauungstrakts und der Leber. Der Follow-up der Kohorte ist beinahe vollständig, unter anderem, da die Auswanderung von Mitgliedern der Kohorte ins Ausland vernachlässigbar war.
Ergebnisse
Es traten in der untersuchten Kohorte im Zeitraum 1991 bis 2002 insgesamt 2 636 Krebstodesfälle (ohne Leukämie) auf. Dies entsprach einem ERR-Wert pro Dosis von 1,26 (95 %-KI: –0,27 – 3,00) Sv–1. Da die Tumoren, die mit dem Konsum von Alkohol in Verbindung gebracht werden, zusammen einen relativ hohen ERR-Wert pro Dosis von 4,64 Sv–1 ergaben, wurden diese Tumoren in einer weiteren Analyse ausgeschlossen. Dann ergaben sich für die übrigen Krebsarten außer Leukämie bei insgesamt 1 949 Todesfällen ein ERR-Wert pro Dosis von 0,20 (95 %-KI: –1,42 – 2,09) Sv–1. Dies sehen die Autoren als Hauptergebnis ihrer Analyse. Eine ähnliche Analyse ergab, wenn neben Leukämie Tumoren, die mit dem Rauchverhalten in Verbindung gebracht werden, ausgeschlossen wurden, einen ERR-Wert pro Dosis von –0,02 (95 %-KI: –2,65 – 3,04) Sv–1.
Diskussion
Im Gegensatz zu vielen anderen Studien betonen die Autoren insbesondere den Einfluss von Alkoholkonsum auf die abgeleiteten ERR-Werte („Taken together, those findings strongly suggest that alcohol drinking and/or tobacco smoking confounded our ERR estimate for all cancers excluding leukaemia.“), obwohl sie keinen Grund für einen Zusammenhang zwischen Alkoholkonsum und kumulierter Dosis angeben können. Sie merken an, dass ihr Ergebnis (inkl. Tumoren, die mit dem Konsum von Alkohol in Verbindung gebracht werden) ähnlich zu dem in der 15-Länder-Studie abgeleiteten ist (Cardis et al. 2007), dass jedoch dort nicht auf Alkoholkonsum korrigiert wurde, und zudem eine Erhebung des sozio-ökonomischen Status, die dort vorgenommen wurde, möglicherweise nicht ausreicht, um auf Rauchen zu korrigieren.
Aufgrund der großen Unsicherheiten der Punktschätzer sind diese nach Ansicht der Autoren mit dem Ergebnis für die Atombombenüberlebenden kompatibel („The estimate has a wide confidence interval, which includes the ERR/Gy of 0.47 for solid cancer among atomic bomb survivors (Preston et al. 2003).“). Es sei betont, dass der hier zitierte Wert von 0,47 Gy–1 für das ERR pro Dosis nicht unbedingt vergleichbar ist, da die Kohorte der Atombombenüberlebenden durch andere Parameter (Altersstruktur, Anteil männlich/weiblich etc.) als die hier untersuchte Kohorte charakterisiert ist.
B.4.3 Beschäftigte bei der Firma Rocketdyne/Atomics International (Boice et al. 2011)
Diese Studie stellt eine Aktualisierung der in Jacob et al. verwendeten Studie aus dem Jahr 2006 dar (Boice et al. 2006), wobei der Beobachtungs-Zeitraum um neun Jahre bis zum Jahr 2008 verlängert wurde.
Material und Methoden
Die Kohorte schließt alle überwachten Personen ein, die im Zeitraum ab 1. Januar 1948 sechs Monate oder länger bei den in den 1950er Jahren fusionierten kalifornischen Firmen Rocketdyne und Atomics International beschäftigt waren. Insgesamt umfasst die Kohorte 46 970 Personen, von denen 5 801 strahlenexponiert waren (5 335 Männer und 466 Frauen). Der Vitalstatus der 5 801 überwachten Personen wurde auf der Basis von verschiedenen Registern aktualisiert. Ende 2008 waren noch 3 307 Arbeiter am Leben, Todesursachen konnten für 98,5 % ermittelt werden. Der mittlere Follow-up-Zeitraum betrug 33,9 Jahre.
Für die Abschätzung der externen Strahlenexpositionen während der Beschäftigung bei Rocketdyne (Atomics International) wurden Daten der innerbetrieblichen Dosisüberwachung verwendet. Expositionen, die vor oder nach dieser Zeit auftraten, wurden aus anderen Dosisregistern rekonstruiert. Interne Strahlenexpositionen wurden auf der Basis von mehr als 30 000 Bioassay-Messungen und den aktuellsten biokinetischen Modellen für 16 Organe und Gewebearten für 14 Radionuklide berechnet. Dabei lieferte angereichertes Uran den größten Beitrag. Im Mittel betrug die durchschnittliche Dosis durch externe Quellen 13,5 mSv, die mittlere Lungendosis dagegen 19,0 mSv (extern und intern) mit einem Maximum von 3,6 Sv.
Werte für das standardisierte Mortalitätsverhältnis (SMR) wurden berechnet durch Vergleich der Mortalitätsraten mit denen der kalifornischen Bevölkerung. Für die interne Auswertung zur Berechnung des relativen Risikos wurden als Referenzgruppe nicht überwachte Beschäftigte verwendet. Die statistischen Analysen mit den relevanten Einflussgrößen wurden wie in der früheren Studie durchgeführt. Im Gegensatz zu früher wurde der Follow-up durchgeführt bis zum 31. Dezember 2008, bis zum 95. Lebensjahr, zum Todeszeitpunkt oder bis zu dem Zeitpunkt, zu dem die betreffende Person aus der Kohorte ausschied (Lost to follow-up). Bei der Auswertung von soliden Tumoren wurde eine 10-jährige Latenzzeit angenommen und für die Kategorie „alle solide Tumore“ nur externe Dosiswerte verwendet.
Ergebnisse
Insgesamt wurden 684 Todesfälle durch bösartige Neoplasien beobachtet (davon 33 Leukämiefälle). Für diese Kategorie ergab sich im Vergleich zu früher ein leicht niedrigerer SMR-Wert von 0,88 (95 %-KI: 0,81 – 0,95), der jedoch mit dem früheren Wert kompatibel ist (SMR = 0,90 [95 %-KI: 0,82 − 0,99]). Wieder wurde ein signifikanter negativer Trend der Mortalität mit der Dosis für alle Todesursachen (p < 0,01) beobachtet, die Trends für Krebs allgemein und Lungenkrebs waren dagegen wieder nicht signifikant. Die internen Analysen ergaben wie früher keine signifikante Abhängigkeit von der Dosis. Die Autoren geben für das relative Risiko bei 100 mSv für alle Krebsarten außer Leukämie einen Wert von 0,98 (95 %-KI: 0,82 – 1,17) an, wobei hier nur die externe Dosis benutzt wurde.
Diskussion
Es ergab sich trotz des um neun Jahre längeren Beobachtungszeitraums kein Zusammenhang zwischen dem Auftreten von Krebs und der Dosis durch ionisierende Strahlung. Dies mag an der vergleichsweise niedrigen Anzahl an Kohortenmitgliedern und an der relativ niedrigen mittleren Dosis liegen. Trotzdem konnten RR-Werte größer als 1,17 bei 100 mSv für alle Krebsarten außer Leukämie mit 95 %iger Wahrscheinlichkeit ausgeschlossen werden. Die Autoren schließen mit der Feststellung, dass für eine Quantifizierung der Risiken durch kontinuierliche Exposition mit ionisierender Strahlung größere Kohorten nötig sind („Larger combined studies of early workers in the Unites States using similar methodologies are warranted to refine and clarify radiation risks after protracted exposures.“).
B.4.4 Beschäftigte bei der französischen „Atomic Energy Commission“ und der Firma AREVA (Metz-Flamant et al. 2011)
In der Studie von Jacob et al. 2009 wurde auch eine Kohorte von Beschäftigten in der französischen Nuklearwirtschaft berücksichtigt, bei der sich ein damals nicht veröffentlichter ERR-Wert pro Dosis von 1,5 (90 %-KI: –0,5 – 4,0) Gy–1 ergab, der von M. Telle-Lamberton im Rahmen einer privaten Mitteilung zur Verfügung gestellt wurde. Die vorliegende Arbeit stellt eine Aktualisierung mit einem etwa zehn Jahre längeren Follow-up-Zeitraum dar.
Material und Methoden
Die vorliegende Studie beinhaltet Untersuchungen an 36 769 Personen, die mindestens ein Jahr zwischen den Jahren 1950 und 1994 bei der französischen Atomenergiebehörde CEA oder der Firma AREVA (die früher COGEMA hieß und im Jahr 1976 von CEA abgespalten wurde) arbeiteten und für die Daten zur externen Exposition verfügbar waren. In militärischen Bereichen und in Uranminen Beschäftigte wurden nicht untersucht. Der Follow-up-Zeitraum reichte von Anfang 1968 bis Ende 2004. Informationen zum Gesundheitsstatus und zu Todesursachen wurden von nationalen Registern eingeholt, wobei durch Rauchen induzierte Krebsarten gesondert berücksichtigt wurden. Als Indikator für den sozio-ökonomischen Status wurden fünf Kategorien für den Beruf bei Einstellung erhoben (Manager einschließlich Ingenieure, Verwaltungsangestellte, Ausbildungsberufe, Berufe ohne Ausbildung, unbekannt).
Alle verwendeten Dosisangaben basierten auf der im beruflichen Strahlenschutz üblichen Bestimmung der Dosis mit persönlichen Dosimetern. Verursacht wurden die gespeicherten Dosen hauptsächlich durch Gamma- und Röntgenstrahlung. Personen mit einer eingetragenen Neuronenexposition wurden nicht aus der Studie ausgeschlossen, die Neutronendosis auf Grund der mit deren Bestimmung verbundenen hohen Unsicherheit jedoch nicht berücksichtigt. Auch Beschäftigte mit einer möglichen internen Exposition wurden nicht ausgeschlossen, um die statistische Power der Studie nicht zu verschlechtern. War die Exposition unterhalb der Nachweisgrenze des verwendeten Dosismeters, wurde die Dosis als 0 Sv gewertet. Dies war für etwa 46 % der Beschäftigten der Fall.
Die statistische Auswertung der Daten schloss einen Vergleich mit der Mortalität der französischen Bevölkerung ein (externe Analyse). Daraus ergaben sich standardisierte Mortalitätsverhältnisse (SMR) als Funktion von Geschlecht, Alter (5-Jahres-Intervalle), und Kalenderjahr (5-Jahres-Intervalle). Für die internen Analysen wurde das Geschlecht, Alter und Kalenderjahr (5-Jahres-Intervalle), Arbeitgeber, sozio-ökonomischer Status und Dosis (in sieben Dosisgruppen) herangezogen. Das zusätzliche relative Risiko (ERR) pro Dosis wurde für die Mortalität an allen Krebsarten und für Untergruppen mittels Poisson-Regression berechnet, unter Annahme eines linearen Dosis-Wirkungsmodells und einer Latenzzeit von zehn Jahren.
Ergebnisse
Von den 36 769 untersuchten Personen waren 82 % Männer. Es wurden 5 443 Todesfälle verzeichnet, darunter 2 035 Fälle durch solide Tumoren, und nur 0,3 % der Personen gingen der Studie verloren (Lost to follow-up). Der mittlere Follow-up-Zeitraum betrug 27,6 Jahre, wobei das mittlere Alter am Ende der Studie bei 59,7 Jahren lag. Bei den 56 % (100 %) der Beschäftigten, bei denen mindestens einmal (keine) eine messbare Dosis auftrat, betrug die mittlere kumulierte Dosis 21,5 mSv (12,1 mSv), der maximale Wert 554,6 mSv.
Die externen Analysen ergaben für alle soliden Tumoren zusammen mit einem SMR-Wert von 0,70 (95 %-KI: 0,67 − 0,74) einen signifikanten Healthy-Worker-Effekt. Signifikant erhöht waren Todesfälle durch Melanome (1,64 [95 %-KI: 1,17 – 2,24]) und Rippenfellkrebs (1,67 [95 %-KI: 1,17 – 2,34]). Für alle soliden Tumoren zusammen ergaben die externen Analysen einen positiven aber nicht signifikanten Wert für das ERR pro Dosis von 0,46 (90 %-KI: –0,48 – 1,54) Sv–1.
Diskussion
Wird nicht nach sozio-ökonomischem Status stratifiziert, so ergibt sich für alle soliden Tumoren zusammen ein deutlich höherer und signifikanter ERR-Wert pro Dosis von 1,73 (90 %-KI: 0,60 – 3,00) Sv–1, was die Bedeutung dieses Parameters unterstreicht. Dabei ist wichtig zu betonen, dass Studien ohne Information zum sozio-ökonomischen Status nicht in die 15-Länder-Studie von Cardis et al. (2005) aufgenommen wurden. Eine frühere Studie der CEA-AREVA-Kohorte ergab deutlich höhere Risikoschätzer (Telle-Lamberton et al. 2007). Dies liegt laut Autoren vermutlich an einer ungenügenden Berücksichtigung des sozio-ökonomischen Status. Die Autoren vergleichen ihr Ergebnis mit einem Wert von 0,26 Sv–1, den sie für einen Atombombenüberlebenden für ein Alter > 50 Jahre und ein Alter bei Exposition von > 30 Jahren angeben. Die Autoren schließen mit der Bemerkung, dass ein positiver aber nicht signifikanter Trend des ERR mit der Dosis gefunden wurde, der mit dem bei den Atombombenüberlebenden gefundenen kompatibel ist, aber auch mit dessen Hälfte („The central estimated ERR per Sv for solid cancer mortality in our cohort was higher than the ERR per Sv estimated among the Hiroshima and Nagasaki A-bomb survivors. Nonetheless, the confidence interval for this estimated ERR per Sv in our study is consistent with both the ERR per Sv found among Hirohsima and Nagasaki A-bomb survivors and an ERR per Sv half that size.“).
B.4.5 Beschäftigte bei der „Electricité de France“ (Laurent et al. 2010)
Die Kohorte der bei der Electricité de France (EDF) Beschäftigten war Teil der 15-Länder-Studie (Cardis et al. 2007), wobei die dort verwendete Follow-up-Periode bis zum Jahr 1994 in der vorliegenden Arbeit um neun Jahre verlängert wurde.
Material und Methoden
Die vorliegende Studie beinhaltet Untersuchungen an 22 393 Personen (davon 763 Frauen), die an 19 Standorten eingesetzt waren. Der Follow-up des Vitalstatus begann zum frühesten der folgenden Zeitpunkte: entweder ab dem Zeitpunkt, ab dem Dosisdaten verfügbar waren, oder ein Jahr nach der Einstellung oder am 1. Januar 1968. Er endete zum frühesten der folgenden Zeitpunkte: Todeszeitpunkt, zum Zeitpunkt der letzten Information (Lost of follow-up) oder zum 31. Dezember 2003. Informationen zum Vitalstatus und zu Todesursachen wurden aus nationalen Registern und internen Quellen gewonnen.
Die Dosis durch hoch-energetische Photonen (100 keV bis 3 000 keV) wurde mit Filmdosimetern bestimmt, deren Kalibrierfaktoren im Rahmen der Studie aktualisiert wurden. Daraus wurde unter Verwendung geeigneter Konversionsfaktoren auch Organdosen berechnet. Informationen zu Neutronenexpositionen wurden verwendet, um Arbeiter, deren Neutronendosis mehr als 10 % der von 1967 bis 2003 kumulierten Photonendosis betrug, zu identifizieren und falls gewünscht von der Analyse ausschließen zu können. Daten zu internen Dosen wurden nicht verwendet, da nur wenige Personen betroffen waren (zwischen den Jahren 1983 und 2003 wurden nur vier Fälle gemeldet).
Als Parameter für die statistische Auswertung wurden neben der kumulierten Photonendosis (7 Dosiskategorien), Alter und Kalenderjahr (jeweils 5-Jahres-Perioden), Geschlecht, Ausbildungs- und Jobstatus bei Einstellung, Standort des Arbeitsplatzes bei Einstellung, Dauer der Anstellung und mögliche Neutronenexposition berücksichtigt. Bei der Auswertung der soliden Tumoren wurde eine Latenzzeit von zehn Jahren angenommen. Durch Rauchen induzierte Krebsarten wurden gesondert berücksichtigt. Alle Ergebnisse werden als relatives Risiko bei 100 mSv angegeben, wobei eine log-lineare Abhängigkeit mit der Dosis angenommen wurde mit dem Zusatz, dass bei kleinen Dosiswerten und Risiken lineare und log-lineare Modelle ähnliche Ergebnisse liefern.
Ergebnisse
Der mittlere Follow-up-Zeitraum betrug 20 Jahre, wobei das mittlere Alter beim Ende der Studie bei 49 Jahren lag. Von den 22 393 Personen gingen nur 0,3 % der Studie verloren und für 96 % der 874 beobachteten Todesfälle konnte die Todesursache bestimmt werden. Es traten 283 Todesfälle durch Krebs (ohne Leukämie) auf. Die mittlere kumulierte Dosis war 21,5 mSv, wobei weniger als 5 % der Personen eine Dosis von mehr als 100 mSv aufwies. Insgesamt wurden 436 (2 %) Arbeiter als Neutronen-exponiert identifiziert mit einer mittleren Gesamtneutronendosis von 7,05 mSv.
Für alle Krebsarten ohne Leukämie ergab sich ein relatives Risiko bei 100 mSv von 0,71 (90 %-KI: 0,44 − 1,06). Die Autoren betonen, dass eine Vielzahl von Sensitivitätsanalysen, bei denen unter anderem die Latenzzeit variiert wurde, keine wesentlich anderen Ergebnisse lieferten.
Diskussion
Die Vorteile der Kohorte liegen darin, dass nur wenige Personen dem Follow-up verloren gingen und dass nur geringe Wahrscheinlichkeit bestand, dass die Mitglieder der Kohorte auch bei anderen Firmen arbeiteten und dort mit zusätzlichen Dosen exponiert wurden. Daten zu anderen Karzinogenen wie Asbest standen nicht zur Verfügung. Als Maß für Tabak- und Alkoholkonsum mussten Angaben zum sozio-ökonomischen Status (Bildungsniveau) verwendet werden. Obwohl im Vergleich zu der in der Publikation von Cardis et al. (2007) verwendeten EDF-Kohorte in der vorliegenden Arbeit der Follow-up um neun Jahre verlängert wurde und sich dadurch die Zahl der beobachteten Todesfälle verdoppelte, ist die statistische Power der Studie begrenzt, und ein Zusammenhang zwischen Krebsmortalität und Exposition mit ionisierender Strahlung konnte nicht nachgewiesen werden. Die Autoren schließen mit der Feststellung, dass auf Grund der begrenzten statistischen Aussagekraft dieses Ergebnisses nicht auf das Fehlen eines derartigen Zusammenhangs geschlossen werden dürfe („Our results do not demonstrate an absence of effect of protracted exposure to radiation on cancer mortality.“).
B.4.6 Dritte Analyse von strahlenexponierten Arbeitern in Großbritannien (Muirhead et al. 2009)
In Großbritannien werden seit dem Jahr 1976 überwachte Beschäftigte im Rahmen einer epidemiologischen Studie untersucht. Erste Ergebnisse wurden in den Jahren 1992 und 1999 veröffentlicht (Kendall et al. 1992, Muirhead et al. 1999a, b). Die hier diskutierte Studie stellt die dritte Auswertung dar mit einem zusätzlichen Follow-up-Zeitraum von neun Jahren und mehr als 50 000 zusätzlichen Arbeitern (Muirhead et al. 2009). Diese Studie wurde in der Meta-Analyse von Jacob et al. (2009) berücksichtigt, nicht jedoch in der 15-Länder-Studie von Cardis et al. (2005).
Material und Methoden
Die Analyse schließt 174 541 Arbeiter ein, die bei insgesamt 12 Arbeitgebern angestellt und überwacht worden sind, wobei auch Expositionen vor 1976 mit berücksichtigt wurden. Etwa 99 % aller in Frage kommenden Beschäftigten nahmen an der Studie teil. Weniger als 10 % der Teilnehmer sind Frauen. Der Follow-up-Zeitraum endete am 31. Dezember 2001. Zu diesem Zeitpunkt waren 28 320 Personen gestorben, 4 579 ausgewandert, und der Status von 1 036 Personen war unklar.
Die meisten Expositionen betrafen Röntgen- oder Gamma-Strahlung, wobei weniger häufig („to a lesser extent“) auch Beta- und Neutronenstrahlung auftreten konnten. Beschäftigte mit einer möglichen Inkorporation von Radionukliden wurden identifiziert, eine Abschätzung der damit verbundenen internen Dosis konnte jedoch nicht durchgeführt werden. Die mittlere Lebenszeitdosis betrug für die Mitglieder der Kohorte 24,9 mSv, wobei mehr als 10 000 Personen (etwa 6 %) Dosen größer als 100 mSv aufwiesen. Diese Personen trugen 59 % zur gesamten Kollektivdosis von 4 348 Personen-Sievert bei.
Der Follow-up begann entweder zum Einstellungsdatum, zum Zeitpunkt, ab dem Dosisinformationen verfügbar waren, oder am 1. Januar 1955. Das Ende des Follow-ups war der früheste Zeitpunkt der folgenden Ereignisse: Tod oder Auswanderung, der 85. Geburtstag oder das Ende des Follow-ups (1. Januar 2002). Externe Analysen wurden durchgeführt, indem zur Berechnung von standardisierten Mortalitäts-Verhältnissen (SMRs) die Mortalität in der Kohorte mit der der Bevölkerung von England und Wales verglichen wurde. Todesursachen wurden entsprechend der ICD-Kodierung angegeben. Die internen Analysen konzentrierten sich auf die Inzidenz und die Mortalität an Krebs (organspezifisch) und anderen Erkrankungen. Stratifiziert wurde nach Alter (in Fünfjahres-Gruppen), Geschlecht, Zeitraum ab dem Jahr 1955 (in Fünfjahres-Gruppen, wobei die letzte Gruppe den Zeitraum 2000 bis 2001 betraf), Betriebsklassifizierung (Industrie, nicht Industrie, unbekannt) und erstem Arbeitgeber. Die Dosen wurden angegeben in den Kategorien 0, bis 10 mSv, bis 20 mSv, bis 50 mSv, bis 100 mSv, bis 150 mSv, bis 200 mSv, bis 400 mSv, und > 400 mSv. Bei der Auswertung der Krebsdaten wurden eine lineare Dosis-Wirkungsbeziehung und eine Latenzzeit von zehn Jahren angenommen.
Ergebnisse
In der Kohorte wurde eine gegenüber der Allgemeinbevölkerung deutlich niedrigere Sterblichkeitsrate beobachtet (Healthy-Worker-Effekt). Entsprechend waren für alle Todesursachen zusammen und für alle bösartigen Neoplasmen als Todesursache die SMR-Werte signifikant kleiner als 1. Die internen Analysen ergaben einen signifikanten Trend der Krebsmortalität mit zunehmender Dosis, wenn alle Krebs-Todesursachen zusammen ohne Leukämie ausgewertet wurden (ERR-Wert pro Dosis: 0,275 [90 %-KI: 0,02 – 0,56] Sv–1). Auch wenn zusätzlich die rauch-assoziierten Krebsarten der Lunge und des Rippenfells ausgenommen wurden, änderte sich das Ergebnis kaum (ERR-Wert pro Dosis: 0,323 [90 %-KI: 0,02 – 0,67] Sv–1). Für 19 Krebsarten war der Punktschätzer für das ERR positiv, für neun war er negativ.
Diskussion
Im Gegensatz zu den beiden erwähnten früheren Auswertungen der überwachten Beschäftigten in Großbritannien ergab sich in der vorliegenden Studie zum ersten Mal eine signifikante Assoziation zwischen der Krebsmortalität (ohne Leukämie) und der Dosis. Die Ergebnisse aller drei Auswertungen sind statistisch konsistent, wobei die vorliegende Auswertung auf Grund des längeren Follow-ups und der größeren Anzahl an Kohortenmitgliedern eine deutlich kleinere statistische Unsicherheit aufweist. Die Autoren betonen, dass diese Ergebnisse konsistent mit denen der 15-Länder-Studie (Cardis et al. 2007) und der Life Span Study (nach BEIR VII) sei. Sie weisen außerdem darauf hin, dass es unter Zugrundelegung einer linearen Dosis-Wirkungsbeziehung unwahrscheinlich sei, dass das Risiko einer beruflichen Strahlenexposition mehr als einen Faktor 2 höher ist als das, das aus der LSS abgeleitet wird. Nach Einschätzung der Autoren der Studie ist das vorliegende Ergebnis mit einem DDREF-Faktor von 1,5, wie er von BEIR VII vorgeschlagen wurde, kompatibel; es deutet zudem eher auf einen DDREF-Wert von kleiner als 2 als von größer als 2 hin („The NRRW-3 data are consistent with the BEIR VII factor and provide more evidence in favour of a solid cancer DDREF that is less than two rather than greater than two, but this latter possibility cannot be ruled out.“).
B.4.7 Beschäftigte am Oak Ridge National Laboratory – Mortalität (Stayner et al. 2007)
In der Arbeit von Stayner und Mitarbeitern wurde die Gruppe der am Oak Ridge National Laboratory Beschäftigten, die bereits Teil der 15-Länder-Studie waren, neu ausgewertet (Stayner et al. 2007). Dabei wurde besonderer Wert auf die Modellierung von dosimetrischen Unsicherheiten gelegt. Die Ergebnisse dieser Arbeit wurden von Jacob und Mitautoren berücksichtigt.
Material und Methoden
Die Kohorte schließt alle überwachten Beschäftigten ein, die mindestens ein Jahr angestellt und durch hochenergetische Photonenstrahlung exponiert waren. 328 Personen, die wesentlich (mit mehr als 10 % der Ganzkörperdosis) durch andere Quellen exponiert wurden (Neutronen, inkorporierte Radionuklide), wurden von der Studie ausgeschlossen, ebenso wie ein Arbeiter, der aufgrund eines Unfalls einer erhöhten Dosis ausgesetzt war, bzw. Arbeiter, die mindestens einmal eine jährliche Dosis von mehr als 250 mSv erhalten hatten. 390 Personen wurden aus anderen Gründen (z. B. fehlende jährliche Dosisangabe) ausgeschlossen. Schließlich wurden in die Kohorte 5 345 Personen aufgenommen. Für 93,2 % der Arbeiter war der Vitalstatus bekannt, die Todesursache für 98,9 % (Vrijheid et al. 2007).
Insgesamt umfasste die Kohorte 136 673 Personenjahre. Es traten im Follow-up-Zeitraum (Mittelwert: 25,6 Jahre) 1 029 Todesfälle, davon 225 durch Krebs (alle Arten ohne Leukämie), auf. Im Mittel betrug die durchschnittliche effektive Dosis der Mitglieder der Kohorte 15,2 mSv (Median: 4,2 mSv). Das mittlere Alter beim Ende des Follow-ups betrug 56,7 Jahre, das mittlere Alter bei erster Exposition 30,1 Jahre (Vrijheid et al. 2007).
Für SMR-Analysen wurde die erwartete Zahl an Todesfällen (alle Ursachen und alle Krebsarten) berechnet für verschiedene Altersgruppen, Kalenderperioden und Zeitdauern der Beschäftigung. Diese Rechnungen basierten auf Daten für die Normalbevölkerung der USA in Abhängigkeit vom Alter, Geschlecht und Kalenderjahr. Die internen Analysen berücksichtigten den sozio-ökonomischen Status (SES) stratifiziert nach Alter, Geschlecht und Kalenderjahr. Daten zum Rauchverhalten waren in dieser Kohorte nicht verfügbar. Den Auswertungen der Mortalität durch alle Krebsarten lag eine Latenzzeit von zehn Jahren zu Grunde (Vrijheid et al. 2007).
Für die untersuchte Kohorte existierten individuelle Dosiswerte. Auf diese Werte mussten jedoch (z. B. in der 15-Länder-Studie) Korrekturfaktoren angewendet werden, die z. B. labor- und zeitabhängige Mess- und Kalibriermethoden berücksichtigten. Da diese Faktoren ebenfalls Unsicherheiten aufwiesen, trugen sie bei einer Gesamtanalyse der Daten zu einem sogenannten gemeinsamen Fehler („shared error“) bei. Stayner und Mitarbeiter berücksichtigten diesen Fehler mittels Monte-Carlo-Simulationen (Stayner et al. 2007).
Ergebnisse
Laut Vrijheid et al. (2007) ergab sich für diese Kohorte für alle Todesursachen ein ausgeprägter Healthy-Worker-Effekt mit einem SMR-Wert von 0,72 (95 %-KI: 0,68 – 0,77). Stayner und Mitarbeiter berichteten, dass sich für den Risikokoeffizient mit der konventionellen Auswertung ein ERR-Wert pro Dosis von 5,39 (90 %-KI: 0,54 – 12,58) Sv–1 ergab (Stayner et al. 2007; Cardis et al. 2005). Werden die dosimetrischen Unsicherheiten entsprechend der von Stayner und Mitarbeiter vorgeschlagenen Methode berücksichtigt, ergibt sich dagegen ein ERR-Wert pro Dosis von 4,82 (90 %-KI: 0,41 – 13,31) Sv–1.
Diskussion
Beide Auswertemethoden ergeben einen relativ hohen Punktschätzer des ERR pro Dosis. Aufgrund der geringen Größe der Kohorte sind die zugehörigen Konfidenz-Intervalle jedoch groß. Wie zu erwarten, ist das Konfidenz-Intervall bei Berücksichtigung der dosimetrischen Unsicherheiten etwas breiter als ohne deren Berücksichtigung. Die Autoren der Studie betonen, dass auf Grund des relativ flachen Verlaufs der Wahrscheinlichkeitsverteilungen sowie deren ähnlichen Maximums beide Ergebnisse nicht unterscheidbar sind. In der Studie von Jacob und Mitarbeiter wurden die Ergebnisse von Stayner et al. und nicht die der 15-Länder-Studie verwendet.
B.4.8 Hanford-Arbeiter (Wing and Richardson 2005)
Diese Arbeit wurde in Jacob et al. 2009 berücksichtigt.
Material und Methoden
Im während des zweiten Weltkriegs errichteten Hanford-Komplex wurde waffenfähiges Plutonium produziert und Nuklearforschung betrieben. Seit den 1960er Jahren wird eine Kohorte von ca. 33 500 Beschäftigten epidemiologisch untersucht. Die jüngste Auswertung der Kohorte (Wing and Richardson 2005) schloss 19 684 Männer und 6 705 Frauen ein, die zwischen 1944 und 1978 eingestellt wurden, für die dosimetrische Aufzeichnungen vorlagen, die mindestens 180 Tage in Hanford beschäftigt waren und die weder vor Einschluss in die Kohorte strahlenexponiert noch an anderen DOE-Standorten angestellt oder bei deren Aufbau beteiligt gewesen waren. Zwei Arbeiter mit akuten unfallbedingten Expositionen und zwei Arbeiter mit Jahresdosen über 250 mSv wurden nicht berücksichtigt. Todeszeitpunkt und -ursache bis zum 31. Dezember 1994 wurden über einen Abgleich mit dem nationalen Mortalitätsindex ermittelt. Bei 2 265 der insgesamt 8 153 Todesfälle war Krebs als Grundleiden oder Begleiterkrankung verzeichnet.
Für die meisten Beschäftigten waren jährliche externe Dosen (hauptsächlich Gamma-Strahlung und Tritium) für die Jahre 1944 bis 1989 vorhanden. Rund 14 % der Männer und 6 % der Frauen kamen auch mit Plutonium in Berührung. Lücken in der Expositionserfassung wurden über einen 13-stufigen Algorithmus geschlossen (Richardson et al. 1999). 3 170 Arbeiter hatten eine kumulative Dosis von über 50 mSv, darunter 88 der 2 265 Krebstodesfälle.
Untersucht wurden „Todesursachen insgesamt“, „Krebs insgesamt“, „Lungenkrebs“ und „Leukämie ohne CLL“, wobei als mögliche Confounder die folgenden Parameter berücksichtigt wurden: Alter bei Exposition (in 5-Jahres-Intervallen), Geburtskohorte, ethnische Zugehörigkeit, Geschlecht, Indikatoren für den sozio-ökonomischen Status (SES) wie aktueller Beschäftigungsstatus, die Durchführung von In-vivo-Monitoring sowie eine mögliche Plutonium-Exposition. Das Rauchverhalten konnte wegen fehlender Daten nicht berücksichtigt werden. Die Dosen wurden addiert in den Kategorien 0, bis 10 mSv, bis 20 mSv, bis 50 mSv, bis 100 mSv, bis 150 mSv, bis 200 mSv, bis 300 mSv und > 300 mSv mit Latenzzeiten von fünf Jahren, zehn Jahren und 15 Jahren. Ein lineares Dosis-Wirkungsmodell wurde mit Poisson-Regression angepasst.
Ergebnisse
Unabhängig von der gewählten Latenzzeit sind die nach den obigen Confoundern adjustierten Risikokoeffizienten (zusätzliches relatives Risiko [ERR] je Dosis) nicht signifikant positiv für Krebs insgesamt, jedoch signifikant positiv bei Lungenkrebs bei Annahme von Latenzzeiten von fünf oder zehn Jahren. Eine detailliertere Analyse zeigte, dass signifikant positive Risikokoeffizienten nur für Expositionen im Alter 55 bis 82 beobachtet wurden, wobei die Werte mit der Latenzzeit stiegen und die Werte für Krebs insgesamt von denen für Lungenkrebs beeinflusst wurden. Eine klare Dosis-Wirkungsbeziehung zeichnete sich nicht ab: Es ergab sich für alle Altersgruppen zusammen und einer Latenzzeit von zehn Jahren, die bei den Kohorten der Beschäftigten in der Nuklearindustrie meist verwendet wird, ein ERR-Wert pro Dosis von 0,28 (90 %-KI: –0,30 – 1,00) Sv–1.
Diskussion
Die erhöhten Risikokoeffizienten in der höchsten Altersgruppe widersprechen den aus der Life Span Study (LSS) bekannten Beobachtungen. Allerdings wurde auch in der Kohorte der Anwohner der Tetscha (s. Krestinina et al. 2005) ein erhöhter Risikokoeffizient für höhere Alter gefunden.
In einer zusätzlichen kleinen Fall-Kohorten-Studie der Hanford-Arbeiter wurden die medizinischen Akten von 86 Lungenkrebsfällen und einer geschichteten Stichprobe von 445 Probanden untersucht (Petersen et al. 1990). Es wurde kein Zusammenhang zwischen dem Rauchverhalten und der Strahlenexposition festgestellt. Diese Studie ist sehr klein, stützt sich nur auf vorhandene Akten, und die Risikoschätzer sind mit großen Unsicherheiten behaftet. Obwohl in der Fall-Kohorten-Studie keine Korrelation zwischen Rauchen und Strahlenexposition gefunden wurde, könnte eine solche Korrelation in der Gesamtkohorte bestanden und den hohen Wert für das Lungenkrebsrisiko durch Strahlung bedingt haben.
B.4.9 Beschäftigte in der Nuklearindustrie in den USA (Howe et al. 2004)
Diese Veröffentlichung beschreibt die erste Analyse zur Mortalität von Beschäftigten in der US-Nuklearindustrie. Die Kohorte ist Teil der 15-Länder-Studie (Cardis et al. 2005). Sie wurde nicht in der Arbeit von Jacob et al. berücksichtigt und wird daher hier beschrieben.
Material und Methoden
Die Kohorte umfasst 53 698 Personen (davon 11,9 % Frauen), die zwischen 1. Januar 1979 und 31. Dezember 1997 in einem von 52 Kernkraftwerken beschäftigt und mindestens ein Jahr überwacht wurden. Der Zeitraum 1979 bis 1997 wurde gewählt, da in dieser Periode Informationen des National Death Index verfügbar waren. Es standen folgende Daten zur Verfügung: Name, Geburtsdatum, Geschlecht, ethnische Zugehörigkeit, Beruf und sozio-ökonomischer Status (basierend auf Angaben zur Ausbildung).
Dosisinformationen stammten von den jeweiligen Arbeitgebern, der Nuclear Regulatory Commission und dem Department of Energy. In der vorliegenden Arbeit wurden die Dosis-Datensätze dieser drei Quellen erstmals zusammengeführt. Der überwiegende Dosisanteil stammte von Photonen mit einer Energie größer als 100 keV, und nur etwa 4 % der Personen wies auch eine Neutronendosis auf. Personen, bei denen die Neutronendosis mehr als 10 % der gesamten Dosis betrug, wurden aus der Analyse ausgeschlossen, genauso wie Personen, die auf mögliche Inkorporationen überwacht wurden. Dosiswerte unterhalb der Nachweisgrenze wurden als 0 Sv gewertet.
Todesfälle und deren Ursachen wurden über den National Death Index identifiziert. Die statistische Auswertung der Daten erfolgte mittels Poisson-Regression und schloss die Parameter Geschlecht, ethnische Zugehörigkeit (2 Kategorien), Alter und Datum (jeweils 5-Jahres-Intervalle), Standort (6 Kategorien), sozio-ökonomischer Status (7 Kategorien), Überwachungsstatus (2 Kategorien) und Dosis (4 bis 12 Kategorien) ein. Für alle Todesursachen außer Leukämie wurde eine Latenzzeit von zehn Jahren angenommen. Durch Vergleich mit der Mortalität der US-Bevölkerung wurden standardisierte Mortalitätsverhältnisse (SMR) berechnet, etwaige Dosisabhängigkeiten wurden durch Berechnung von ERR-Werten auf der Basis einer internen Analyse untersucht, wobei sowohl kategorielle Werte (um etwaige Abweichungen von einer linearen Dosis-Wirkungsbeziehung zu untersuchen) als auch ein lineares Dosismodell (das eine größere statistische Power als die kategorielle Auswertung aufweist und mit dem zusätzlichen relativen Risiko pro Dosis einen Parameter liefert, der in vielen anderen Studien ebenfalls angegeben wird) angenommen wurde.
Ergebnisse
Insgesamt lagen der Studie 698 051 Personenjahre zu Grunde, und es wurden 1 190 Todesfälle (davon 368 Todesfälle durch solide Tumoren) identifiziert. Der mittlere Follow-up-Zeitraum lag bei 13,0 Jahren. Die mittlere Dosis betrug in der Kohorte 25,7 mSv, wobei der Mittelwert derer, die mindestens einen Dosiseintrag hatten, bei 30,7 mSv lag.
Die externe Analyse ergab einen ausgeprägten Healthy-Worker-Effekt mit SMR-Werten von 0,65 für alle Krebsarten. Für denselben Endpunkt ergab die interne Analyse einen positiven, jedoch nicht signifikant von Null verschiedenen Punktschätzer für das zusätzliche relative Risiko pro Dosis (0,51 [95 %-KI: –2,01 – 4,64] Sv–1). Es konnten nur für das lineare Modell belastbare Ergebnisse erzielt werden, andere Abhängigkeiten konnten dagegen nicht untersucht werden („The present study did not have sufficient power to investigate alternative forms of dose–response relationship, in common with other nuclear worker studies“).
Diskussion
Die Autoren betonen die Stärken der Studie (genaue Dosisangaben aus drei verschiedenen Quellen, zuverlässige Informationen zu Todesursachen auf Grund der Daten des National Death Index), verschweigen jedoch auch die Schwächen nicht (z. B. die geringe Anzahl an Todesfällen, das junge Alter der Kohorte bei Ende des Follow-ups von im Mittel 45 Jahren und das Fehlen von Informationen zum Rauchen und anderen Confoundern). Insbesondere weisen sie darauf hin, dass der Wert für das zusätzliche relative Risiko pro Dosis ähnlich dem in der LSS, jedoch mit einem hohen Fehler behaftet ist („In summary, the results of the present cohort study provide estimates of the ERR … that are similar to the point estimates found in the atomic bomb survivors study … . However, the confidence intervals are wide and are consistent with no risk at all or with much higher risks.“).
B.4.10 Beschäftigte in der Nuklearindustrie in Kanada (Zablotska et al. 2004)
Diese Veröffentlichung ist das Pendant zu der Publikation von Howe et al. (2004) und beschreibt eine Analyse zur Mortalität aller Beschäftigten in der kanadischen Nuklearindustrie, die im kanadischen Dosisregister registriert sind. Die Kohorte ist Teil der 15-Länder-Studie (Cardis et al. 2005), wurde ebenfalls nicht in die Analyse von Jacob et al. eingeschlossen. Das Fehlen dieser Studie in der Analyse von Jacob und Mitautoren wurde von Trabalka et al. 2010 kritisiert. Daher wird sie hier beschrieben.
Material und Methoden
In dieser Studie wurden 45 468 Personen (davon 17 % Frauen) untersucht, die mindestens ein Jahr überwacht wurden und für die genügend Informationen vorlagen, damit sie in der Canadian Mortality Data Base identifiziert werden konnten. Die Mitglieder der Kohorte waren beschäftigt bei Atomic Energy of Canada Ltd oder bei den drei kanadischen Firmen, die Kernkraftwerke betrieben. Der Follow-up der Kohorte begann in Jahr 1957 und endete in Jahr 1994.
Für alle Personen waren die zugehörigen Dosiswerte im kanadischen Dosisregister (NDR) verfügbar. Expositionen bestanden im Wesentlichen aus Niedrig-LET-Strahlung, wobei für Gamma-, Beta- und Röntgenstrahlung ein Qualitätsfaktor von 1 angenommen wurde. Bei den wenigen Fällen von (niedrigen) Neutronenexpositionen wurde zur Berechnung der Äquivalentdosis ein Qualitätsfaktor von 10 bzw. in einer Firma nach dem Jahr 1986 ein Qualitätsfaktor von 20 verwendet. Eine Angleichung der Werte im Rahmen der Datenanalyse erfolgte jedoch nicht. Interne Expositionen durch Inkorporation von Tritium wurden bei der Berechnung der individuellen Äquivalentdosen ebenfalls berücksichtigt, die Inkorporationen anderer Radionuklide dagegen vernachlässigt. Da die Nachweisgrenze der verwendeten Dosimeter generell 0,2 mSv war, wurden Werte darunter als 0 Sv gewertet.
Die statistische Auswertung der Daten erfolgte mittels Poisson-Regression. Dabei wurden die Parameter Geschlecht, Alter und Datum (jeweils 5-Jahres-Intervalle), sozio-ökonomischer Status (4 Kategorien), Dauer der Überwachung (5 Kategorien), Dosis (4 bis 12 Kategorien) und Überwachungsstatus (2 Kategorien) berücksichtigt. Dauer der Überwachung wurde anstelle von Dauer der Anstellung zur Quantifizierung des Healthy-Worker-Effekts verwendet. Für 43 % der Mitglieder der Kohorte konnte der sozio-ökonomische Status nicht bestimmt werden. Kumulative Dosen von mehr als 500 mSv (51 Fälle) wurden ausgeschlossen. Für alle Todesursachen außer Leukämie wurde eine Latenzzeit von zehn Jahren angenommen.
SMR-Werte ergaben sich durch Vergleich mit Todesraten der kanadischen Bevölkerung unter Berücksichtigung von Geschlecht, Alter, Kalenderjahr und Todesursache. Zur Berechnung von ERR-Werten wurde das Modul AMFIT des Softwarepakets EPICURE verwendet, wobei ein lineares Dosis-Wirkungsmodell angenommen wurde.
Ergebnisse
Insgesamt lagen der Studie 607 979 Personenjahre zu Grunde. Der mittlere Follow-up-Zeitraum lag bei 13,4 Jahren. Es traten kumulative Dosiswerte zwischen 0 und 498,9 mSv auf, wobei die mittlere Dosis in der gesamten Kohorte bei 13,5 mSv lag (mit einem Mittelwert derer, die mindestens einen Dosiseintrag hatten, von 19,7 mSv).
Für solide Tumoren ergab sich bei 474 im Follow-up-Zeitraum aufgetretenen Todesfällen (von insgesamt 1 599 Todesfällen) ein ausgeprägter Healthy-Worker-Effekt mit einem SMR-Wert von 0,73 für alle Krebsarten. Für denselben Endpunkt ergab die interne Analyse einen positiven, jedoch nicht signifikant von Null verschiedenen Punktschätzer für das zusätzliche relative Risiko pro Dosis (2,80 [95 %-KI: –0,038 – 7,13] Sv–1). Auch ohne Lungenkrebs ergaben sich ähnliche Werte, sodass das Ergebnis allem Anschein nach nicht signifikant durch Rauchen beeinflusst wurde. Abweichungen von einer linearen Dosis-Wirkungsbeziehung konnten wie bei Howe et al. (2004) nicht untersucht werden.
Diskussion
Die Autoren benennen als Stärken der Studie die Beobachtung von Effekten bei niedrigen Dosen und kleinen Dosisleistungen, genaue Dosisangaben und einen Follow-up-Zeitraum von 38 Jahren. Als Nachteile sehen sie die geringe statistische Power und die unzureichende Information zu potenziellen Confoundern wie dem Rauchen. Sie betonen, dass ihre Ergebnisse weder vom sozio-ökonomischen Status noch von der Tritiumdosis abhingen, und dass die Expositionen durch Neutronen und Alpha-Emitter vernachlässigbar waren. Sie schließen mit der Feststellung, dass der Punktschätzer für das ERR pro Dosis positiv und nicht signifikant von Null verschieden und höher als der bei anderen Kohorten wie zum Beispiel von den Atombombenüberlebenden abgeleitete ist („Although the point estimates are higher than those found in other studies of whole-body exposure to ionizing radiation, the wide confidence bounds indicate the differences could be due to chance.“).
Laut Trabalka et al. (2010) spielt die Problematik der Dosisrekonstruktion in den kanadischen Daten (s. CNSN 2011) in der Studie von Zablotska et al. keine Rolle. Trabalka et al. stützen sich dabei auf eine private Mitteilung von Zablotska et al. Laut CNSN (2011) sind von dieser Problematik Personen, die vor dem Jahr 1965 (1956 bis 1964) bei der Atomic Energy of Canada Limited (AECL) eingestellt wurden, betroffen. Da jedoch in der Studie von Zablotska et al. (2004) nur AECL-Beschäftigte vor dem Jahr 1957 ausgeschlossen wurden, sollten die vorliegenden Ergebnisse mit Vorsicht
interpretiert werden. Dies bestätigt eine Analyse von Ashmore und Mitautoren, die zeigten, dass beim Transfer der AECL-Daten in das Nationale Dosisregister (NDR) Daten von Beschäftigten, für die im Zeitraum 1956 bis 1970 ein Dosiswert von Null aufgezeichnet worden war, nicht weitergegeben wurden (Ashmore et al. 2010).
Kürzlich wurde von Zablotska et al. eine neue Auswertung der Daten zur Krebsmortalität der in der kanadischen Nuklearindustrie Beschäftigten durchgeführt. Dazu schlossen die Autoren Personen, die bei AECL vor dem Jahr 1956 beschäftigt waren, aus der Analyse aus, jedoch Personen mit Dosis Null, die dort zwischen den Jahren 1956 und 1971 beschäftigt waren, in die Analyse ein, und berücksichtigten zusätzlich auch Informationen zum sozio-ökonomischen Status und zur Dosis durch Tritium. Die Analyse, die auf dem vom 30. September bis 3. Oktober 2012 stattgefundenen 58. jährlichen Treffen der Radiation Research Society vorgestellt wurde, ergab ein ERR pro Dosis von 1,77 (95 %-KI: –0,42 – 5,30) Sv–1.
B.4.11 Anwohner an der Tetscha (Krestinina et al. 2005)
In der Mayak-Produktionsgenossenschaft in Ozyorsk im Südural wurde unter anderem Plutonium für die sowjetischen Atomwaffen hergestellt. In den ersten Produktionsjahren 1949 bis 1952 wurden große Mengen flüssiger radioaktiver Abfälle in den Fluss Tetscha geleitet, wodurch die flussabwärts lebende Bevölkerung sowohl intern (insbesondere durch Inkorporation von 90Sr) als auch extern exponiert wurde.
Material und Methoden
Die verwendete erweiterte Kohorte der Anwohner an der Tetscha (Extended Techa River Cohort, ETRC) besteht aus 29 873 Personen, die im Zeitraum 1950 bis 1960 zumindest zeitweilig in einem der 41 Orte an der Tetscha gewohnt haben, die dem Freisetzungspunkt der Mayak-Produktionsgenossenschaft flussabwärts am nächsten lagen und die vor dem 1. Januar 1950 geboren wurden. Zum Zeitpunkt des Beginns der Exposition durch die Kontamination der Tetscha (1. Januar 1950 oder Zeitpunkt des Zuzugs in das kontaminierte Gebiet) war das mittlere Alter der Kohortenmitglieder 25 Jahre. Die älteren Kohortenmitglieder waren überwiegend weiblich.
Zwischen 1. Januar 1950 und 31. Dezember 1999 wurden Mortalitätsdaten für die Mitglieder der Kohorte erhoben, die in den Verwaltungsbezirken Chelyabinsk und Kurgan gemeldet waren. Insgesamt 7 023 Kohortenmitglieder hatten entweder die beiden Bezirke verlassen, oder es konnten für sie keine aktualisierten Daten erhoben werden (Lost of follow-up). Von den übrigen Kohortenmitgliedern verstarben 14 380 Personen. Für 89 % von ihnen lagen Informationen über die Todesursache vor. Diese Information wurde in 90 % von 182 Autopsien bestätigt.
Systematische Messungen der radioaktiven Kontamination der Tetscha und der angrenzenden Gebiete begannen im Sommer 1951. Ganzkörpermessungen von 90Sr und 137Cs begannen im Jahr 1974. Für ca. ein Drittel der Kohortenmitglieder liegen Ergebnisse von 90Sr-Messungen vor. Das in der Studie verwendete Dosimetriesystem TRDS-2000 (Techa River Dosimetry System 2000) basiert auf der Auswertung dieser Daten, einem Modell für die Entwicklung der Kontaminationssituation in dem Zeitraum, für den keine Messdaten vorliegen, und Daten über Wohnzeiten der Kohortenmitglieder in den einzelnen Orten. Dabei wurden neben 89Sr, 90Sr und 137Cs sechs weitere kurzlebige Radionuklide berücksichtigt. Es werden jeweils jährliche Dosiswerte für externe und interne Strahlenexposition angegeben, die auf den altersabhängigen Dosiswerten in denjenigen Orten beruhen, in denen sich das Kohortenmitglied bis zum Zeitpunkt des betreffenden Jahres aufgehalten hat. Dabei war die externe Exposition durch 137Cs nur in den nahe am Freisetzungspunkt gelegenen Orten von Bedeutung, im Gegensatz zur internen Exposition, die auch in weiter entfernten Orten eine Rolle spielte.
Die epidemiologischen Daten wurden in Gruppen aggregiert, die unter anderem durch Geschlecht, Zeitpunkt des Beginns der Exposition, Alter bei Beginn der Exposition, Alter, Zeit seit Beginn der Exposition und kumulativer Dosis unter Berücksichtigung einer Verzögerungszeit zwischen Exposition und erstem möglichen Auftreten eines induzierten Krebsfalls (Latenzzeit) charakterisiert waren. Aufenthaltszeiten außerhalb der beiden Bezirke Chelyabinsk und Kurgan wurden nicht berücksichtigt. Für die Analyse solider Krebstumoren (außer Knochenkrebs) wurde die Magendosis mit einer Latenzzeit von fünf Jahren verwendet. Knochenkrebs wurde bei den soliden Tumoren wegen einer möglichen Assoziation mit der Strontiumexposition ausgeschlossen.
Das Hintergrundrisiko wurde durch eine geschlechtsspezifische Funktion des Alters mit Abhängigkeiten von Geburtsjahr, ethnischer Zugehörigkeit (Slawe oder Baschkir/Tartar) und Bezirk des Wohnorts beschrieben. Zusätzliche Risiken (relativ [ERR] und absolut [EAR]) wurden als ein Produkt einer dosisabhängigen Funktion und modifizierender Faktoren modelliert. Die Modellparameter wurden mit einer Poisson-Regression für die maximale Wahrscheinlichkeit der in den Gruppen aufgetretenen Krebsfälle (maximum likelihood method) bestimmt.
Ergebnisse
Im Beobachtungszeitraum wurden 1 842 Todesfälle durch solide Krebstumoren außer Knochenkrebs (18 Fälle) registriert. Kohortenmitglieder mit Magendosen größer als 300 mGy trugen etwa 2 % zu den Personenjahren und 4 % zu den Krebstodesfällen (73 Fälle) bei. Für kein Kohortenmitglied war die Magendosis größer als 500 mGy. Im Mittel lag die Magendosis bei 30 mGy.
In einem linearen Risikomodell ergab sich ein hochsignifikanter ERR-Wert pro Dosis von 0,92 (95 %-KI: 0,2 – 1,7) Gy–1 (p < 0,001). Es gab keinen Hinweis auf eine Nicht-Linearität der Dosis-Wirkungsbeziehung, obwohl auch eine linear-quadratische Beziehung untersucht wurde („… no evidence for significant non-linearity …“). Nach dem Modell sind ca. 46 der Todesfälle mit der Strahlenexposition assoziiert. Der Risikokoeffizient nimmt mit zunehmendem Alter zu (p = 0,03), der beste Schätzwert für 70-Jährige ist um einen Faktor 6 höher als für 40-Jährige.
Das EAR je Dosis ergab sich für ein Alter von 70 Jahren zu 70,5 (95 %-KI: 25 – 118) Fällen je 104 Personenjahre und Gy. Auch das EAR nimmt mit dem Alter zu. Unter der Annahme, dass die Todesursachen unter den 11 % der Mitglieder der Kohorte, für die die Todesursache nicht bekannt ist, ähnlich wie bei der Kohorte ist, ergeben sich um ca. 10 % höhere EAR-Werte.
Diskussion
Die in der Kohorte der Anwohner an der Tetscha beobachtete Zunahme des ERR mit dem Alter steht einerseits im Widerspruch zu Beobachtungen bei den Atombombenüberlebenden, wurde jedoch auch bei den Arbeitern von Hanford (Wing und Richardson 2005) und bei den Nukleararbeitern in 15 Ländern (Cardis et al. 2007) beobachtet. Eine Klärung dieses Widerspruchs ist noch nicht erfolgt. Gegenwärtig hat die Studie allerdings zwei wesentliche Schwächen: Zum einen ist ein großer Prozentsatz (23,5 %) der Kohortenmitglieder dem Follow-up verloren gegangen und nur für 89 % der Verstorbenen ist die Todesursache bekannt, zum anderen weist die Dosimetrie noch große Unsicherheiten auf. Die Autoren erwähnen, dass die Dosimetrie zum Zeitpunkt der Veröffentlichung ihrer Arbeit neu bewertet wird und dass eine Erhöhung der Dosisabschätzungen zu erwarten ist, was zu einer Erniedrigung der abgeleiteten Risikoschätzungen führen könnte. Ein Vergleich mit den LSS-Risikoschätzungen kann laut der Autoren daher noch nicht abschließend durchgeführt werden („In view of the dosimetric uncertainties noted above, comparisons between the radiation-associated cancer risks for atomic bomb survivors … and ETRC members … cannot be conclusive at this time“).
B.4.12 Aufräumarbeiter nach dem Unfall von Tschernobyl (Ivanov et al. 2006)
Die hier analysierte Kohorte ist eine Teilkohorte der allgemeinen Kohorte von Aufräumarbeitern und umfasst 29 003 Personen. Alle Personen sind männlich, hatten ihren Wohnort in sechs administrativen Gebieten im europäischen Teil der Russischen Föderation, waren vor dem 1. Januar 1992 im russischen Medizinischen und Dosimetrischen Register eingetragen, hatten einen Wert für die externe Dosis und mindestens eine medizinische Untersuchung nach dem Verlassen der Tschernobyl-Zone bis zum 31. Dezember 2002 und waren an den Aufräumarbeiten im Zeitraum 26. April 1986 bis 26. April 1987 beteiligt. Die meisten Arbeiter waren 18 bis 44 Jahre alt, nur 1 543 Personen waren älter. Bis zum 31. Dezember 2002 traten 651 Todesfälle durch solide maligne Tumoren auf.
Die den Teilnehmern der Studie zugeordnete Dosis basierte entweder auf der Messung mit individuellen Dosimetern (Thermolumineszenzdosimeter oder Filmdosimeter) oder auf einer Gruppendosis, die mit einem einzelnen Dosimeter für eine Gruppe von Aufräumarbeitern gemessen wurde, oder auf der Multiplikation von mittleren Dosisleistungen an den jeweiligen Einsatzorten und den zugehörigen Aufenthaltsdauern. Die mittlere Dosis der Aufräumarbeiter betrug 156 mGy. 446 Aufräumarbeiter erhielten Dosen größer als 250 mGy, 94 Arbeiter Dosen größer als 300 mGy.
Die Mortalität solider Tumoren als Funktion der externen Dosis wurde mit einem Modell für das zusätzliche relative Risiko (ERR) unter Annahme einer linearen Dosis-Wirkungsfunktion ausgewertet.
Ergebnisse
Für die Gesamtheit aller soliden Tumoren war die Mortalität in der Dosisgruppe größer 100 mGy gegenüber der Kontroll-Gruppe (< 50 mGy) signifikant erhöht, und das relative Risiko lag bei 1,61 (95 %-KI: 1,01 – 2,25). Für die lineare Dosis-Wirkungsbeziehung ergab sich ein ERR-Wert pro Dosis von 1,52 (95 %-KI: 0,20 – 2,85) Gy–1. Es wurde geschätzt, dass 125 der 651 beobachteten Todesfälle mit der Strahlenexposition assoziiert waren.
Diskussion
In der Kohorte wurden keine Angaben zum Rauchen und zum sozialen Status erhoben, was ihre Aussagekraft einschränkt, zumal Atemwegstumoren in dieser Kohorte die häufigste Ursache der Krebsmortalität waren. Weitere Beschränkungen liegen in der Dosimetrie, die besonders für die Personen ohne individuelle Dosimeter unsicher ist. Obwohl die besten Schätzwerte des Risikokoeffizienten für die Mortalität durch alle soliden Tumoren und durch Lungenkrebs deutlich höher sind als in der Studie der Atombombenüberlebenden von Hiroshima und Nagasaki, sind die Ergebnisse aufgrund der großen Unsicherheitsbereiche miteinander verträglich.
B.5 Einzelstudien − Inzidenz
B.5.1 Bewohner in Kerala, Indien (Nair et al. 2009)
Material und Methoden
Die Autoren nahmen insgesamt 173 067 Bewohner von vier Gebieten in Kerala mit einer hohen natürlichen Strahlenexposition und zwei Referenz-Gebieten mit niedriger Exposition in die Studie auf. Nach Beschränkung auf Personen mit einem Alter bei Studienbeginn zwischen 30 Jahren und 84 Jahren und mit vernachlässigbaren beruflichen Expositionen blieben schließlich 69 958 Personen, davon 32 085 Männer, übrig. Der Studie gingen im Studienzeitraum von 13 Jahren 0,7 % der Teilnehmer verloren.
Es wurden einmalig jeweils fünf-minütige Dosismessungen in 71 674 Haushalten durchgeführt – jeweils eine im Haus, in dem Raum mit der längsten Aufenthaltsdauer, und eine im Freien in einer Entfernung von 3 m zum Eingang des Hauses. Der Vergleich mit den Ergebnissen von Langzeit-Messungen (Messdauer: ein Jahr) in 800 Haushalten ermöglichte es, aus den Kurzzeitmessungen Jahresdosen zu berechnen. Auf der Basis von Interviews wurden für mehr als 7 700 Bewohner Aufenthaltsdauern im Inneren der Häuser und im Freien bestimmt, die als repräsentativ für die Gesamtkohorte angesehen wurden. Mit diesen Ergebnissen konnten die Autoren individuelle Kolon-Dosiswerte für alle Teilnehmer berechnen, wobei sie den Beitrag der kosmischen Strahlung abzogen und Dosis-Konversionsfaktoren der ICRP benutzten. Die Dosis durch mit der Nahrung zugeführte oder inhalierte Radionuklide wurde nicht berücksichtigt. Zur Qualitätssicherung wurde zusätzlich bei 160 Personen die Personendosis mit passiven Dosimetern über einen Zeitraum von zwei Monaten bestimmt und gute Übereinstimmung mit den Dosiswerten, die mit dem oben beschriebenen Verfahren berechnet wurden, erzielt.
Die aufgetretenen Krebsfälle wurden über das Krebsregister in Karunagappally identifiziert. Zur Erhebung der Daten besuchten Mitarbeiter des Krebsregisters monatlich das regionale Krebszentrum von Kerala, in dem etwa die Hälfte der registrierten Fälle behandelt werden. Sie suchten zudem jährlich alle relevanten Krankenhäuser und analytischen Labors der Gegend auf. Drei- bis viermal im Jahr wurden zudem Einrichtungen besucht, die Krebs-Reihenuntersuchungen anbieten. Als Beginn des Follow-ups verwendeten die Autoren das Datum des Interviews (zwischen 1. Januar 1990 und 31. Dezember 1997). Als Ende benutzten sie entweder das Diagnosedatum, den Wegzug aus dem Studiengebiet, den 85. Geburtstag oder das Ende der Studie (31. Dezember 2005).
Die Daten wurden mittels Poisson-Regression unter Verwendung des Programms AMFIT unter Annahme einer linearen Dosis-Wirkungsbeziehung ausgewertet, wobei die folgenden Parameter berücksichtigt wurden: Geschlecht, Alter (5-Jahres-Kategorien), Follow-up-Zeitraum (3 Kategorien). Zur Erhebung des sozio-ökonomischen Status wurden Angaben zu Religion, Bildung, Einkommen und Beruf gesammelt, zur Erhebung des Rauchverhaltens Angaben zum Rauchen von Zigaretten und Bidis sowie zum Kauen von Tabak. Für alle Krebsarten außer Leukämie wurde eine Latenzzeit von zehn Jahren angenommen. Bei der Berechnung des relativen Risikos wurde die Kategorie 0 bis 49 mGy als Referenzkategorie für die kumulierte Dosis verwendet.
Ergebnis
Insgesamt ergab der Follow-up einen Zeitraum von 736 586 Personenjahren, und es wurden 1 349 Krebsfälle ohne Leukämie (davon 747 bei Männern) identifiziert. Die mittlere kumulierte Dosis von terrestrischer Gamma-Strahlung betrug im Untersuchungszeitraum 161 mGy. In 73 % der Fälle wurde die Diagnose histopathologisch bzw. zytologisch bestätigt. Die Autoren konnten bei keiner der verwendeten Gruppen der kumulierten Dosis (0 bis 49, 50 bis 99, 100 bis 199, 200 bis 499, und > 500 mGy) ein signifikant von 1 verschiedenes relatives Risiko beobachten. Unter der Annahme einer linearen Dosis-Wirkungskurve ergab sich ein ERR-Wert pro Dosis von –0,13 (95 %-KI: –0,58 – 0,46) Gy–1. Dabei wurde stratifiziert nach Geschlecht, Alter, Follow-up-Zeitraum, Rauchen von Bidis, Bildung und Beruf.
Diskussion
Die Autoren zählen als Vorteile ihrer Studie auf, dass a) die untersuchten Personen in ländlichen Gegenden lebten, sodass eine Exposition mit anderen Karzinogenen eher unwahrscheinlich war, b) die Verwendung von Inzidenz- an Stelle von Mortalitätsdaten, c) die Tatsache, dass die medizinische Versorgung in Kerala besser als in anderen Gegenden Indiens ist, d) das Vorhandensein von Daten zum Lebensstil wie das Rauchen von Bidis, die etwa dreimal mehr Kohlenmonoxid und viermal mehr Teer als Zigaretten enthalten. Nachteile sehen sie unter anderem darin, dass a) keine Informationen zu medizinischen Expositionen und b) zu internen Dosen, z. B. durch den Zerfall von Radon in der Lunge vorhanden waren. Allerdings betonen sie, dass sich der ERR-Wert pro Dosis nur geringfügig ändert, wenn Lungenkrebs ausgeschlossen wurde (ERR-Wert pro Dosis: –0,14 [95 %-KI: –0,62 – 0,50] Gy–1). Auch die geringe statistische Power der Studie sehen sie als Nachteil, betonen jedoch, dass die mittlere kumulierte Dosis in ihrer Studie mit 161 mGy deutlich höher war als die z. B. in der 15-Länder-Studie von 19,4 mSv (Cardis et al. 2007). Nach Meinung der Autoren zeigt das Ergebnis ihrer Studie, dass die Krebsrisiken durch Exposition mit niedrigen Dosen ionisierender Strahlung vermutlich nicht viel höher sein können, als sie momentan angenommen werden („… these findings suggest it unlikely that estimates of cancer risk at low doses are substantially greater than currently believed.“).
B.5.2 Aufräumarbeiter nach dem Unfall von Tschernobyl (Ivanov et al. 2009)
In der Studie von Jacob et al. 2009 wurde als aktuellste Analyse zur Krebsinzidenz bei den Aufräumarbeitern nach dem Unfall von Tschernobyl eine Arbeit von Ivanov et al. aus dem Jahr 2004, in der ein Follow-up-Zeitraum von 1991 bis 2001 untersucht wurde, berücksichtigt. Die vorliegende Arbeit (Ivanov et al. 2009) basiert dagegen auf einem Follow-up-Zeitraum von 1986 bis 2005.
Material und Methoden
In der Studie von (Ivanov et al. 2009) wurden 55 770 russische Männer untersucht, die im Jahr 1986 oder 1987 erstmalig in der 30-km-Zone in Tschernobyl für Aufräumarbeiten eingesetzten worden waren. Alle Personen nahmen jährlich an einer medizinischen Untersuchung teil, und für alle lagen Daten hinsichtlich Geburtstag, Registrierungsdatum, Dosis sowie zu Ankunft und Verlassen der Aufräumzone vor. Im Follow-up-Zeitraum gingen der Studie 14 % der Teilnehmer verloren. Insgesamt wurden in der Kohorte bei 990 393 Personenjahren 2 718 Fälle solider Tumoren beobachtet.
Wie in der früheren Arbeit (Ivanov et al. 2004) fanden bei der Bestimmung individueller (externer) Dosen drei Verfahren Anwendung: In den meisten Fällen (85 %) wurde die Dosis mit individuellen Dosimetern erfasst. Die restlichen Dosisangaben basierten entweder auf Messungen mit einem einzelnen Dosimeter, die für eine Gruppe von Personen als repräsentativ angesehen wurde, oder wurden auf Grund von mittleren Dosisleistungen an den jeweiligen Einsatzorten und den Aufenthaltsdauern abgeschätzt. Die mittlere Dosis der eingesetzten Personen betrug 130 mSv bei einer mittleren Dosisleistung von 2,30 mSv/d.
Bei der statistischen Analyse der Daten wurde neben dem zusätzlichen relativen Risiko (ERR) pro Dosis, das auf der Basis einer linearen Dosis-Wirkungsbeziehung ermittelt wurde, besonderer Wert auf die Latenzzeit gelegt. Dazu wurde der Logarithmus der Likelihood-Funktion als Funktion des ERR pro Dosis und der Latenzzeit berechnet und nach Maxima (lokal und global) gesucht.
Ergebnisse
Das globale Maximum des Logarithmus der Likelihood-Funktion wurde bei einer Latenzzeit von 4,0 Jahren (95 %-KI: 3,3 – 4,9 Jahre) gefunden. Das zugehörige relative Risiko pro Dosis war 0,96 (95 %-KI: 0,28 – 1,72) Gy–1. Zusätzlich wurden einige lokale Maxima gefunden bei längeren Latenzzeiten, die einhergingen mit niedrigeren Werten für das ERR pro Dosis.
Diskussion
Die Autoren betonen, dass die mit den Dosisangaben verbundenen Unsicherheiten im Einzelfall beträchtlich sein können (bei individuellen Dosimetern maximal 50 % im Falle unsachgemäßer Tragweise, bei Gruppendosimetern maximal 300 % aufgrund unbekannter Gradienten des Strahlenfelds am Einsatzort und bei Dosisabschätzungen maximal 500 % auf Grund unklarer Informationen zum Einsatzort bzw. zur dort herrschenden Dosisleistung).
Häufig wird in epidemiologischen Studien, insbesondere bei den hier vorgestellten Studien zu den Nukleararbeitern, für solide Tumoren eine Latenzzeit von zehn Jahren angenommen. In einigen Fällen werden im Rahmen von Sensitivitätsanalysen dann weitere Werte für die Latenzzeit verwendet, die jedoch in der Regel zu keinen signifikant unterschiedlichen Werten für das ERR pro Dosis führen. Die vorliegende Arbeit stellt insofern eine Ausnahme dar. Die Autoren betonen, dass eine Latenzzeit von vier Jahren zwar deutlich kürzer als die meist verwendete Latenzzeit von zehn Jahren ist, dass es jedoch durchaus in der Literatur Hinweise auf eine kürzere Latenzzeit gibt, wie zum Beispiel im BEIR VII-Bericht, wo für die US-Bevölkerung eine Latenzzeit von fünf Jahren angenommen wird, oder in der LSS-Kohorte, bei der bereits im Zeitraum 1950 bis 1955 ein erhöhtes strahleninduziertes Risiko für das Auftreten solider Tumoren besteht. Das Auftreten von Nebenmaxima führen die Autoren auf das Vorhandensein von Personengruppen mit geringerer Strahlenempfindlichkeit (und mit entsprechend längeren Latenzzeiten) zurück.
In der früheren Studie der Gruppe (Ivanov et al. 2004) ergab sich ein ERR pro Dosis von 0,34 (95 %-KI: –0,39 – 1,22) Gy–1, wobei eine Latenzzeit von zehn Jahren angenommen wurde. Mit einem Wert von zehn Jahren ergibt die vorliegende Studie (bei etwa einer Verdoppelung der Personenjahre) einen Wert für das ERR pro Dosis von 0,2 (95 %-KI: –0,4 – 0,8) Gy–1, was dann mit dem früheren Ergebnis kompatibel ist.
In der Studie von Cardis et al. (2007) wird als Hauptergebnis unter der Annahme einer Latenzzeit von zehn Jahren ein ERR pro Dosis von 0,97 (90 %-KI: 0,27 – 1,8) Gy–1 angegeben. Im Gegensatz zur hier diskutierten Studie liefern jedoch kürzere Latenzzeiten tendenziell niedrigere Werte (z. B. eine Latenzzeit von fünf Jahren einen Wert von 0,76 (90 %-KI: 0,17 – 1,45) Gy–1).
B.5.3 Dritte Analyse von strahlenexponierten Arbeitern in Großbritannien (Muirhead et al. 2009)
Diese Studie wurde im Detail bereits weiter oben in Kapitel B.4 beschrieben.
Ergebnisse
Für die Inzidenz von allen Krebsarten zusammen (ohne Leukämie) ergab sich ein zunehmender Trend mit zunehmender Dosis, und für den ERR-Wert pro Dosis ergab sich 0,266 (90 %-KI: 0,04 – 0,51) Sv–1. Für 19 Krebsarten war der Punktschätzer für das ERR positiv, für 10 Krebsarten war er negativ.
Diskussion
Wie bereits weiter oben für die Mortalität erwähnt, ist das vorliegende Ergebnis nach Einschätzung der Autoren der Studie mit einem DDREF-Faktor von 1,5, wie er von BEIR VII vorgeschlagen wurde, kompatibel; es deutet zudem eher auf einen DDREF-Wert von kleiner als 2 als von größer als 2 hin („The NRRW-3 data are consistent with the BEIR VII factor and provide more evidence in favour of a solid cancer DDREF that is less than two rather than greater than two, but this latter possibility cannot be ruled out.“).
B.5.4 Anwohner an der Tetscha (Krestinina et al. 2007)
In der vorliegenden Studie wurde wie in der Untersuchung von Krestinina et al. aus dem Jahr 2005 zur Mortalität die erweiterte Kohorte der Anwohner der Tetscha (Extended Techa River Cohort, ETRC) verwendet. Vollständige Daten zur Krebsinzidenz liegen in dieser Kohorte allerdings erst ab dem Jahr 1956 vor und auch nur für Personen aus der Stadt und dem Verwaltungsbezirk Chelyabinsk. Daher konnte nur ein Teil der ETRC-Kohorte in die Inzidenzstudie aufgenommen werden. Insgesamt wurden 17 433 lebende Personen untersucht, die vor dem 1. Januar 1956 keine Krebsdiagnose bekommen hatten und irgendwann zwischen den Jahren 1956 und 2002 in der Stadt oder dem Verwaltungsbezirk Chelyabinsk gelebt hatten. Falls eine Person während des 47-jährigen Follow-up-Zeitraums die untersuchte Gegend verlassen hatte, wurde sie in den Analysen nicht weiter berücksichtigt (Lost to follow-up). Insgesamt mussten aus diesem Grund 3 535 Personen ausgeschlossen werden, zudem war für 1 397 Personen der Vitalstatus unbekannt. Die verbliebene Gruppe von 13 989 Personen bestand zu 57 % aus Frauen und hatte zu Beginn des Follow-ups ein mittleres Alter von 28,5 Jahren. Ingesamt traten 1 836 Fälle von soliden Tumoren (ohne Knochenkrebs) auf – bei Männern meist Lungen- und Magenkrebs (29 % und 18 %), bei Frauen dagegen meist Magen-, Gebärmutterhals- und Brustkrebs (16 %, 15 % und 11 %). In etwa der Hälfte der Fälle war die Diagnose histologisch abgesichert. Ansonsten wurden zur Validierung bildgebende Verfahren (Röntgen-, Ultraschallbilder, CT-Scans) oder die Angaben in der Sterbeurkunde verwendet. Die Autoren vermuten, dass mehr als 90 % der tatsächlich aufgetretenen Krebsfälle auch als solche identifiziert wurden.
Das in der Studie verwendete Dosimetriesystem TRDS-2000 (Techa River Dosimetry System 2000) basiert auf mittleren jährlichen ortschaftsspezifischen Dosiswerten, die unter Berücksichtigung von Daten zur Ortsdosisleistung am
Flussufer und in den Ortschaften, zum Verhalten der Bewohner, zur Inkorporation von Radionukliden etc. gewonnen wurden. Diese Daten wurden unter Berücksichtigung von Alter, Migrationsverhalten etc. individualisiert. Schließlich wurden kumulierte Magendosen bestimmt, die von externen Expositionen durch die kontaminierten Flussgegenden und durch Inkorporation von 137Cs (55 % der Gesamtdosis) herrührten. Die mittlere kumulierte Magendosis in der Kohorte betrug 40 mGy (Median: 8 mGy), der Maximalwert 450 mGy. 26 der 1 836 Fälle hatten Magendosen zwischen 200 mGy und 300 mGy, 65 Personen wiesen Magendosen größer als 300 mGy auf.
Die epidemiologischen Daten wurden in Gruppen zusammengefasst, die unter anderem durch Geschlecht, ethnische Zugehörigkeit, Zeitpunkt des Beginns der Exposition, Alter bei Beginn der Exposition, Alter, Zeit seit Beginn der Exposition und kumulative Magendosis unter Berücksichtigung einer Latenzzeit von fünf Jahren charakterisiert waren.
Die Inzidenzdaten wurden auf der Basis eines Excess-Relative-Risk-Modells beschrieben. Für die Dosis-Wirkungskurve wurde eine lineare Dosisabhängigkeit angenommen. Der Einfluss von weiteren Faktoren wie zum Beispiel Geschlecht, ethnische Zugehörigkeit, erreichtes Alter und Alter bei erster Exposition wurde ebenfalls untersucht. Die Modellparameter wurden mit einer Poisson-Regression für die maximale Wahrscheinlichkeit der in den Gruppen aufgetretenen Krebsfälle (maximum likelihood method) bestimmt.
Ergebnisse
In einem linearen Risikomodell ergab sich ein hochsignifikanter ERR-Wert pro Dosis von 1,0 (95 %-KI: 0,3 – 1,9) Gy–1 (p = 0,004). Die Verwendung einer Latenzzeit von zwei Jahren änderte am Ergebnis nichts, die Verwendung von zehn Jahren ergab einen etwa um 10 % geringeren Wert. Daraus ergibt sich, dass etwa 3 % der beobachteten Krebsfälle strahleninduziert waren (95 %-KI: 1 % − 6 %). Ein quadratisches Dosismodell konnte die Daten auch beschreiben, dabei ergab sich ein ERR-Wert von 2,9 (95 %-KI: 0,92 – 5,3) Gy–2. Für dieses Modell war das Risiko unterhalb einer Magendosis von 300 mGy geringer als das, das sich aus dem linearen Modell ergab. Entsprechend waren dann etwa 2 % der beobachteten Krebsfälle strahleninduziert (95 %-KI: 0,5 % − 3 %). Gemäß der Autoren gab sich jedoch kein signifikanter Hinweis auf eine Nicht-Linearität der Dosis-Wirkungsbeziehung („There was no significant non-linearity in the dose response….“).
Diskussion
Diese erste Analyse der Inzidenzdaten der Kohorte der Anwohner an der Tetscha ergab ein signifikantes strahleninduziertes Risiko. Das Ergebnis ist mit dem der Mortalitätsstudie von Krestinina und Mitarbeitern aus dem Jahr 2005 kompatibel (0,92 [95 %-KI: 0,2 – 1,7] Gy–1). Allerdings konnte bei der Analyse der Inzidenzdaten nur 60 % der ursprünglichen Kohorte verwendet werden, und der Follow-up begann sechs Jahre später. Die Autoren weisen darauf hin, dass ihre Studie keine präzisen quantitativen Schätzungen von strahleninduzierten Effekten liefert, jedoch einen starken Hinweis, dass das Risiko linear mit der Dosis steigt („… we feel that they do provide strong evidence that such exposures lead to significant increases in risk that are roughly proportional to dose.“). Sie betonen abschließend, dass aus ihrer Sicht die Daten einen DDREF von 2 nicht unterstützen („At this time these data … do not provide any evidence to support the notion that low dose rate exposures are less effective (per unit dose) than acute exposures such as those received by the atomic bomb survivors.“).
Literatur
| Akiba und Mizuno 2012 | Akiba S und Mizuno S. The third analysis of cancer mortality among Japanese nuclear workers, 1991-2002: estimation of excess relative risk per radiation dose. J Radiol Prot. 2012; 32:73-83 |
| Ashmore et al. 2010 | Ashmore JP, Gentner NE, Osborne RV. Incomplete data on the Canadian cohort may have affected the results of the study by the International Agency for Research on Cancer on the radiogenic cancer risk among nuclear industry workers in 15 countries. J. Radiol. Prot. 2010;30:121-129 |
| BEIR 2006 | Committee to Assess Health Risks from Exposure to Low Levels of Ionizing Radiation, Board on Radiation Effects, Research Division on Earth and Life Studies, National Research Council of the National Academies. Health risks from exposure to low levels of ionizing radiation. BEIR VII – Phase 2. United States National Academy of Sciences. National Academy Press, Washington DC. 2006 |
| Boice et al. 2006 | Boice JD Jr., Leggett RW, Ellis ED, Wallace PW, Mumma M, Cohen SS, Brill AB, Chadda B, Boecker BB, Yoder RC, Eckerman KF. A comprehensive dose reconstruction methodology for former rocketdyne/atomics international radiation workers. Health Phys. 2006;90:409-430 |
| Boice et al. 2011 | Boice JD Jr., Cohen SS, Mumma MT, Ellis ED, Eckerman KF, Leggett RW, Boecker BB, Brill AB, Henderson BE. Updated Mortality Analysis of Radiation Workers at Rocketdyne (Atomics International). Radiat Res. 2011;176:244-258 |
| Cardis et al. 1995 | Cardis E, Gilbert ES, Carpenter L, Howe G, Kato I, Armstrong BK, Beral V, Cowper G, Douglas A, Fix J, Fry SA, Kaldor J, Lavé C, Salmon L, Smith PG, Voelz GL, Wiggs LD. Effects of low doses and low dose rates of external ionizing radiation: cancer mortality among nuclear industry workers in three countries. Radiat Res. 1995;142:117-132 |
| Cardis et al. 2005 | Cardis E, Vrijheid M, Blettner M, Gilbert E, Hakama M, Hill C, Howe G, Kaldor J, Muirhead CR, Schubauer-Berigan M, Yoshimura T, Bermann F, Cowper G, Fix J, Hacker C, Heinmiller B, Marshall M, Thierry-Chef I, Utterback D, Ahn YO, Amoros E, Ashmore P, Auvinen A, Bae JM, Solano JB, Biau A, Combalot E, Deboodt P, Diez Sacristan A, Eklöf M, Engels H, Engholm G, Gulis G, Habib R, Holan K, Hyvonen H, Kerekes A, Kurtinaitis J, Malker H, Martuzzi M, Mastauskas A, Monnet A, Moser M, Pearce MS, Richardson DB, Rodriguez-Artalejo F, Rogel A, Tardy H, Telle-Lamberton M, Turai I, Usel M, Veress K. Risk of cancer after low doses of ionising radiation: retrospective cohort study in 15 countries. BMJ. 2005;331(7508):77 |
| Cardis et al. 2007 | Cardis E, Vrijheid M, Blettner M, Gilbert E, Hakama M, Hill C, Howe G, Kaldor J, Muirhead CR, Schubauer-Berigan M, Yoshimura T, Bermann F, Cowper G, Fix J, Hacker C, Heinmiller B, Marshall M, Thierry-Chef I, Utterback D, Ahn YO, Amoros E, Ashmore P, Auvinen A, Bae JM, Bernar J, Biau A, Combalot E, Deboodt P, Diez Sacristan A, Eklöf M, Engels H, Engholm G, Gulis G, Habib RR, Holan K, Hyvonen H, Kerekes A, Kurtinaitis J, Malker H, Martuzzi M, Mastauskas A, Monnet A, Moser M, Pearce MS, Richardson DB, Rodriguez-Artalejo F, Rogel A, Tardy H, Telle-Lamberton M, Turai I, Usel M, Veress K. The 15-Country Collaborative Study of Cancer Risk among Radiation Workers in the nuclear industry: estimates of radiation-related cancer risks. Radiat Res. 2007;167:396-416 |
| CNSN 2011 | Canada Nuclear Safety Commission (CNSN). Verifying Canadian Nuclear Energy Worker Radiation Risk: A Reanalysis of Cancer Mortality in Canadian Nuclear Energy Workers (1957-1994) − Summary Report. Info-0811, June 2011 |
| Howe et al. 2004 | Howe GR, Zablotska LB, Fix JJ, Egel J, Buchanan J. Analysis of the Mortality Experience amongst US Nuclear Power Industry Workers after Chronic Low-Dose Exposure to Ionizing Radiation. Radiat Res. 2004;162(5):517-526 |
| ICRP 2007 | International Commission on Radiological Protection (ICRP). The 2007 Recommendations of the International Commission on Radiological Protection. Publication 103, Annals of the ICRP 37 (2-4). Pergamon Press, Oxford. 2007 |
| Ivanow et al. 2004 | Ivanow K, Gorski AI, Tsyb AF, Ivanov SI, Naumenko RN, Ivanova LV. Solid cancer incidence among the Chernobyl emergency workers residing in Russia: estimation of radiation risks. Radiat Environ Biophys. 2004;43:35-42 |
| Ivanow et al. 2006 | Ivanow VK, Tumanov KA, Kashcheev VV, Tsyb AF, Marchenko TA, Chekin SYu, Maksioutov MA, Petrov AV, Biryukov AP. Mortality in Chernobyl clean-up workers: analysis of dose-effect relationship. Radiation and Risk. 2006;15:11-22 (auf russisch) |
| Ivanow et al. 2009 | Ivanov VK, Gorsky AI, Kashcheev VV, Maksioutov MA, Tumanov KA. Latent period in induction of radiogenic solid tumors in the cohort of emergency workers. Radiat Environ Biophys. 2009;48:247-252 |
| Jacob et al. 2009 | Jacob P, Rühm W, Walsh L, Blettner M, Hammer G, Zeeb H. Cancer risk of radiation workers larger than expected? Occup. Environ. Med. 2009;66:789-796. published online 30 Jun 2009. doi:10.1136/oem.2008.043265 |
| Kendall et al. 1992 | Kendall GM, Muirhead CR, MacGibbon BH, O’Hagan JA, Conquest AJ, Goodill AA, Butland BK, Fell TP, Jackson DA, Webb MA, Haylock RGE, Thomas JM, Silk TJ. Mortality and occupational exposure to radiation: first analysis of the National Registry for Radiation Workers. Br Med J. 1992;304:220-225 |
| Krestinina et al. 2005 | Krestinina LYu, Preston DL, Ostroumova EV, Degteva MO, Ron E, Vyushkova OV, Startsev NV, Kossenko MM, Akleyev AV. Protracted radiation exposure and cancer mortality in the Techa River Cohort. Radiat Res. 2005;164:602-611 |
| Krestinina et al. 2007 | Krestinina LYu, Davis F, Osroumova EV, Epifanova SB, Degteva MO, Preston DL, Akleyev AV. Solid cancer incidence and low-dose-rate radiation exposure in the Techa River cohort: 1956-2002. Int J Epid. 2007;36:1038-1046 |
| Laurent et al. 2010 | Laurent O, Metz-Flamant C, Rogel A, Hubert D, Riedel A, Garcier Y, Laurier D. Relationship between occupational exposure to ionizing radiation and mortality at the French electricity company, period 1961-2003. Int Arch Occup Environ Health. 2010;83:935-944 |
| Metz-Flamant et al. 2011 | Metz-Flamant C, Samson E, Caër-Lorho S, Acker A, Laurier D. Solid Cancer Mortality associated with chronic external radiation exposure at the French Atomic Energy Commission and Nuclear Fuel Company. Radiat Res. 2011;176:115-127 |
| Muirhead et al 1999a | Muirhead CR, Goodill AA, Haylock RGE, Vokes J, Little MP, Jackson DA, O’Hagan JA, Thomas JM, Kendall GM, Silk TJ, Bingham D, Berridge GLC. Occupational radiation exposure and mortality: second analysis of the National Registry for Radiation Workers. J. Radiol. Prot. 1999;19:3-26 |
| Muirhead et al. 1999b | Muirhead CR, Goodill AA, Haylock RGE, Vokes J, Little MP, Jackson DA, O’Hagan JA, Thomas JM, Kendall GM, Silk TJ, Bingham D, Berridge GLC. Second analysis of the National Registry for Radiation Workers: Occupational exposure to ionising radiation and mortality. National Radiological Protection Board, NRPB-R307, Chilton. 1999 |
| Muirhead et al. 2009 | Muirhead CR, O’Hagan JA, Haylock RGE, Phillipson MA, Willcock T, Berridge GLC, Zhang W. Mortality and cancer incidence following occupational radiation exposure: third analysis of the National Registry for Radiation Workers. Brit. J. Cancer. 2009;100:206-212 |
| Nair et al. 2009 | Nair KRR, Rajan B, Akiba S, Jayalekshmi P, Nair MK, Gangadharan P, Koga T, Morishima H, Nakamura S, Sugahara T. Background radiation and cancer incidence in Kerala, India – Karunagaplpally cohort study. Health Phys. 2009;96:55-66 |
| Ogata 2011 | Ogata H. A review of some epidemiological studies on cancer risk from low-dose radiation or other carcinogenic agents. Radiat Prot Dosim. 2011;146:268-271 |
| Ozasa et al. 2012 | Ozasa K, Shimizu Y, Suyama A, Kasagi F, Soda M, Grant EJ, Sakata R, Sugiyama H, Kodama K. Studies of the mortality of atomic bomb survivors, Report 14, 1950-2003: An overview of cancer and noncancer diseases. Radiat Res. 2012;177:229-243 |
| Petersen et al. 1990 | Petersen GR, Gilbert ES, Buchanan JA, Stevens RG. A case-cohort study of lung cancer, ionizing radiation, and tobacco smoking among males at the Hanford Site. Health Phys. 1990;58:3-11 |
| Preston et al. 2003 | Preston DL, Shimizu Y, Pierce DA, Suyama A, Mabuchi K. Studies of mortality of atomic bomb survivors. Report 13: Solid cancer and noncancer disease mortality: 1950-1997. Radiat Res. 2003;160:381-407 |
| Preston et al. 2004 | Preston DL, Pierce DA, Shimizu Y, Cullings HM, Fujita S, Funamoto S, Kodama K. Effect of recent changes in atomic bomb survivor dosimetry on cancer mortality risk estimates. Radiat Res. 2004;162:377-389 |
| REA 2006 | Radiation Effects Association (REA). The epidemiological study of radiation workers at nuclear power plants and related facilities. Phase III Report to Ministry of Education, Science and Technology. 2006 |
| Richardson et al. 1999 | Richardson D, Wing S, Watson J, Wolf S. Missing annual external radiation dosimetry data among Hanford workers. J Expo. Anal. Environ. Epidemiol. 1999;9:575-585 |
| Richardson und Wing 1999 | Richardson DB und Wing S. Greater sensitivity to ionizing radiation at older age: follow-up of workers at Oak Ridge National Laboratory through 1990. Int. J. Epidemiol. 1999;28:428-436 |
| Schubauer-Berigan et al. 2005 | Schubauer-Berigan M, Macievic G, Utterback D, Tseng C-Y, Flora J. An epidemiologic study of mortality and radiation-related risk of cancer among workers at the Idaho National Engineering and Environmental Laboratory, a US Department of Energy Facility. U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health. 2005 |
| Stayner et al. 2007 | Stayner L, Vrijheid M, Cardis E, Stram DO, Deltour I, Gilbert SJ, Howe G. A Monte Carlo Maximum Likelihood Method for Estimating Uncertainty Arising from Shared Errors in Exposures in Epidemiological Studies of Nuclear Workers. Radiat Res. 2007;168:757-763 |
| Sun et al. 2000 | Sun Q, Akiba S, Tao Z, Yuan Y, Zou J, Morishima H, Kato H, Zha Y, Sugahara T, Wei L. Excess relative risk of solid cancer mortality after prolonged exposure to naturally occurring high background radiation in Yangjiang, China (1979-1998). J Radiat Res. 2000;41(Suppl):43-52 |
| Tao et al. 2012 | Tao Z, Akiba S, Zha Y, Sun Q, Zou J, Li J, Liu Y, Yuan Y, Tokonami S, Morishoma H, Koga T, Nakamura S, Sugahara T, Wei L. Cancer and non-cancer mortality among inhabitants in the high background radiation area of Yangjiang, China (1979-1998). Health Phys. 2012;102:173-181 |
| Telle-Lamberton et al. 2007 | Telle-Lamberton M, Samson E, Caer S, Gergot D, Bard D, Bermann F, Gelas JM, Giraud JM, Hubert P, Hill C. External radiation exposure and mortality in a cohort of French nuclear workers. Occup Environ Med 2007;64:694-700 |
| Thierry-Chef et al. 2007 | Thierry-Chef I, Marshall M, Fix JJ, Berman F, Gilbert E, Hacker C, Heinmiller B, Murray W, Pearce MS, Utterback D, Bernar J, Deboodt P, Eklof M, Griciene B, Holan K, Hyvonen H, Kerekes A, Lee M-C, Moser M, Pernicka F, Cardis E. The 15-country collaborative study of cancer risk among radiation workers in the nuclear industry: study of errors in dosimetry. Radiat Res. 2007;167:380-395 |
| Trabalka et al. 2010 | Trabalka JR, Apostoaei AJ, Hoffman FO, Kocher DC, Thomas BA. Dose and Dose-rate Effectiveness Factors for Low-Let Radiation for Application to NIOSH-IREP. SENES Oak Ridge, Inc., Center for Risk Analysis. Dec 2010, Draft-report |
| Vrijheid et al. 2007 | Vrijheid M, Cardis E, Blettner M, Gilbert E, Hakama M, Hill C, Howe GR, Kaldor J, Muirhead CR, Schubauer-Berigan M, Yoshimura T, Ahn Y-O, Ashmore J P, Auvinen Ad, Bae J-M, Engels H, Gulis G, Habib RR, Hosoda Y, Kurtinaitis J, Malker H, Moser M, Rodriguez-Artalejo F, Rogel A, Tardy H, Telle-Lamberton M, Turai I, Usel M, Veress K. The 15-country collaborative study of cancer risk among radiation workers in the nuclear industry: design, epidemiological methods and descriptive results. Radiat Res. 2007;167:361-379 |
| Wing und Richardson 2005 | Wing S und Richardson DB. Age at exposure to ionising radiation and cancer mortality among Hanford workers: follow up through 1994. Occup Environ Med. 2005;62:465-472 |
| Zablotska et al. 2004 | Zablotska LB, Ashmore JP, Howe GR. Analysis of Mortality among Canadian Nuclear Power Industry Workers after Chronic Low-Dose Exposure to Ionizing Radiation. Radiat Res. 2004;161:633-641 |
| Zablotska et al. 2012 | Zablotska LB, Lane RS, Thompson PA. A Re-analysis of Cancer Mortality of Canadian Nuclear Workers (1957-1994) Based on Revised Exposure and Cohort Data and Implications for Results of the IARC 15-Country Study. 58th Annual Meeting of the Radiation Research Society, Sept 30-Oct 3 2012, 2012;803-819 |
Abbildungsnachweis
- Abbildung 2.1:
-
Dosisleistungs-Effekt: Unter Zugrundelegung einer linear-quadratischen Dosis-Wirkungsbeziehung (Gl. (2.1) und Gl. (2.2)), hier mit α/β = 1 Sv) ergibt sich bei Fraktionierung, d. h. bei Exposition mit mehreren Einzeldosen, eine kleinere Wirkung (durchgezogene Linie) als die Wirkung durch eine einmalige Exposition mit gleicher Dosis (punkt-gestrichelte Linie). Im Grenzübergang zu sehr vielen Fraktionen folgt die Wirkung dem linearen Anteil (gestrichelte Linie) des linear-quadratischen Verlaufs.
- Abbildung 2.2:
-
Linear-quadratische Dosis-Wirkungsbeziehungen für Strahlenarten mit kleinem und mit großem LET. Der Quotient α/β hängt vom LET ab und bezeichnet den Dosiswert, für den der lineare und der quadratische Term gleich groß sind. Beachte: Der quadratische Anteil (gepunktete Linie) ist in beiden Abbildungsteilen gleich.
- Abbildung 2.3:
-
Abhängigkeit des LDEF vom α/β-Verhältnis einer linear-quadratischen Dosis-Wirkungsbeziehung (Gl. (2.2)) bei Extrapolation aus dem Dosisbereich von 1 Sv (gestrichelte Linie) und von 600 mSv (durchgezogene Linie).
- Abbildung 3.1:
-
Anzahl der Bruchstellen pro Zelle bei Chromosomen-Austauschaberrationen in Abhängigkeit von der Dosis bei verschiedenen Dosisleistungen. Die Parameter α und β geben den linearen bzw. quadratischen Term in der linear-quadratischen Beziehung (siehe Gl. 2.1) an, c ist der Achsenabschnitt der Polynome. Dreiecke geben „komplexe“ Aberrationen (mehrere Bruchstellen pro Austausch), Kreise „einfache“ Aberrationen (eine oder wenige Bruchstellen pro Austausch) an.(Aus Loucas et al. 2004; die Verwendung der Abbildung erfolgt mit freundlicher Genehmigung der Zeitschrift „Radiation Research“. Die Abbildungsunterschrift der Originalabbildung Fig. 4 lautet: Exchange breakpoints as a function of acute and chronic dose. Triangular symbols represent the dose response for total exchanges (simple plus complex). Circular symbols show the response for simple exchanges alone. For both high and low dose rates, the induction of simple exchanges is fitted well by a linear model. At high dose rates virtually all of the curvature in the shape of the dose response is due to breakpoints from complex exchanges, whose contribution to total damage becomes significant above 2 Gy. At limiting low dose rates all evidence of upward curvature is gone, and the dose responses for total and simple exchanges are almost superimposable, demonstrating that the relative contribution of complex aberrations is small. Nevertheless, complex aberrations are formed under these conditions, accounting for roughly 10 to 15 % of the total exchange breakpoints.
- Abbildung 4.1:
-
Zusätzliches relatives Risiko (ERR) für alle Tumoren als Funktion der Dickdarmdosis (Gamma-Energiedosis plus der mit einem Faktor von zehn gewichteten Neutronen-Energiedosis). Schwarze Kreise entsprechen ERR-Werten mit den zugehörigen 95 %-Konfidenz-Intervallen (KI) für die gewählten Dosisgruppen. Durchgezogene Linien: lineares Modell (L) (inkl. 95 %-KI, dargestellt als gestrichelte Linien) und linear-quadratisches (LQ) Modell, jeweils für den gesamten Dosisbereich, bzw. linear-quadratisches (LQ(< 2 Gy)) Modell für den Dosisbereich 0 bis 2 Gy.(Aus Ozasa et al. 2012; die Verwendung der Abbildung erfolgt mit freundlicher Genehmigung der Zeitschrift „Radiation Research“. Die Abbildungsunterschrift der Originalabbildung Fig. 4 lautet: Excess relative risk (ERR) for all solid cancer in relation to radiation exposure. The black circles represent ERR and 95 % CI for the dose categories, together with trend estimates based on linear (L) with 95 % CI (dotted lines) and linear-quadratic (LQ) models using the full dose range, and LQ model for the data restricted to dose <2 Gy.)
- Abbildung B.2.1:
-
Zusätzliches relatives Risiko (ERR) für alle Tumoren als Funktion der Dickdarmdosis (Gamma-Energiedosis plus der mit einem Faktor von zehn gewichteten Neutronen-Energiedosis). Schwarze Kreise entsprechen ERR-Werten mit den zugehörigen 95 %-Konfidenz-Intervallen (KI) für die gewählten Dosisgruppen. Durchgezogene Linien: lineares Modell (L) (inkl. 95 %-KI, dargestellt als gestrichelte Linien) und linear-quadratisches (LQ) Modell, jeweils für den gesamten Dosisbereich, bzw. linear-quadratisches (LQ(< 2 Gy)) Modell für den Dosisbereich 0 bis 2 Gy.(Aus Ozasa et al. 2012; die Verwendung der Abbildung erfolgt mit freundlicher Genehmigung der Zeitschrift „Radiation Research“. Die Abbildungsunterschrift der Originalabbildung Fig. 4 lautet: Excess relative risk (ERR) for all solid cancer in relation to radiation exposure. The black circles represent ERR and 95 % CI for the dose categories, together with trend estimates based on linear (L) with 95 % CI (dotted lines) and linear-quadratic (LQ) models using the full dose range, and LQ model for the data restricted to dose <2 Gy.)
- Abbildung B.3.1:
-
Zusätzliches relatives Risiko als Funktion der in Cardis et al. (2007) verwendeten Dosiskategorien (relativ zur < 5 mSv Dosis-Kategorie) einschließlich 90 %-KI.(Aus Cardis et al. (2007); die Verwendung der Abbildung erfolgt mit freundlicher Genehmigung der Zeitschrift Radiation Research. Die Abbildungsunterschrift der Originalabbildung FIG. 1 lautet: Excess relative risk by dose category (relative to <5 mSv category) and 90 % CI: all cancers excluding leukemia, all cancers excluding leukemia, lung and pleural cancers; leukemia excluding CLL. For leukemia excluding CLL, the 400–500 and >500 mSv categories have been combined because these two categories had very extreme values, based on very small numbers of death. In the combined >400 mSv category, the ERR/Sv was 3.73 (90 % CI−0.54, 20.9)).
Tabellennachweis
- Tabelle A.1:
-
Studien zum Effekt der Dosis.
- Tabelle A.2:
-
Studien zum Effekt der Dosisleistung.
- Tabelle B.1:
-
Grundlegende Daten der im Anhang B diskutierten Studien; die Einheit der Dosis ist entsprechend der Originalliteratur angegeben (entweder Gy oder Sv); numerisch sind dadurch für die mittlere kumulierte Dosis und das zusätzliche relative Risiko (ERR) pro Dosis keine wesentlichen Unterschiede zu erwarten, da in der überwiegenden Zahl der Fälle die Exposition durch Strahlung mit niedrigem LET verursacht wurde.
- Tabelle B.3.1:
-
Zusammenstellung der grundlegenden Daten der einzelnen Studien der 15-Länder-Studie von Cardis et al. (2007).
- 1
- Sofern nicht anders angegeben, beziehen sich die Dosisangaben in dieser Empfehlung auf die effektive Dosis.
- 2
- Dosisleistung = Dosis/Zeit (nach DIN 6814, Teil 3). Synonym wird dafür häufig auch der Begriff „Dosisrate“ verwendet.
- 3
- Effektive Dosis < 100 mSv
- 4
- Effektive Dosisleistung < 0,1 mSv/min (nach UNSCEAR 2010)
- 5
- LNT: Linear No Threshold
- 6
- ERR: Excess Relative Risk, zusätzliches relatives Risiko
- 7
- 95 %-KI: 95 %-Konfidenz-Intervall (Vertrauensbereich)
- 8
- Die SSK hat sich bereits mehrfach mit dieser Thematik beschäftigt: siehe SSK-Bd. 56 „Abschätzung, Bewertung und Management von Risiken“ und SSK-Bd. 66 „Risiken ionisierender und nichtionisierender Strahlung“.
- 9
- Sofern nicht anders angegeben, beziehen sich die Dosisangaben in dieser Empfehlung auf die effektive Dosis.
- 10
- Dosisleistung = Dosis/Zeit (nach DIN 6814, Teil 3). Synonym wird dafür häufig auch der Begriff „Dosisrate“ verwendet.
- 11
- Effektive Dosis < 100 mSv
- 12
- Effektive Dosisleistung < 0,1 mSv/min (nach UNSCEAR 2010)
- 13
- LNT: Linear No-Threshold
- 14
- linear energy transfer, dt: linearer Energietransfer
- 15
- DSB wurden im unteren Dosisbereich mit Hilfe von γH2X-Foci, bei höheren Dosen durch Gelelektrophorese bestimmt.
- 16
- Genomische Instabilität ist ein Sammelbegriff, der alle vererbbaren Änderungen von Chromosomen beinhaltet. Dazu gehören einfache Ereignisse, wie eine stabile Chromosomentranslokation, aber auch fortschreitende Chromosomendisruptionen wie im „Breakage-Fusion-Bridge Cycle“ oder einmalige größere Disruptionen mehrerer Chromosomen wie Chromothripsis.
- 17
- Name des Forschungsreaktors beim Argonne National Laboratory (USA).
- 18
- Konfidenz-Intervall
- 19
- LDEF: Low-Dose Effectiveness Factor, vgl. Kapitel 2.2
- 20
- DREF: Dose-Rate Effectiveness Factor, vgl. Kapitel. 2.2
- 21
- Die Strahlenschutzkommission hat sich bereits mehrfach mit dieser Thematik beschäftigt, siehe SSK-Bd. 56: Abschätzung, Bewertung und Management von Risiken und SSK-Bd. 66: Risiken ionisierender und nichtionisierender Strahlung.
- 22
- Relative Biological Effectiveness, dt: relative biologische Wirksamkeit
- 23
- Medical Research Council
- 24
- Ente per le Nuove Tecnologie, l’Energiea e l’Ambiente (dt: italienische Nationalagentur für Neue Technologien, Energie und nachhaltige wirtschaftliche Entwicklung).
- 25
- Das Studienzentrum für Kernenergie (niederländisch Studiecentrum voor Kernenergie/französisch Centre d'Étude de l'énergie Nucléaire, Abk. SCK•CEN) ist ein belgisches Kernforschungszentrum in Mol.
- 26
- European Late Effects Project Group

